Тромбоз воротной вены при панкреатите
Тромбоз воротной вены (ТВВ) – это процесс образования тромба вплоть до полной окклюзии просвета основного ствола и ветвей воротной вены с прогрессирующим нарушением кровотока в печени и ЖКТ. Прижизненные случаи тромбоза воротной вены впервые описали основоположники и корифеи русской медицины С.П. Боткин (1862) и Н.Д. Стражеско (1934) [1–3]. Среди зарубежных клиницистов первое описание ТВВ принадлежит Вalfur и Stewart (1868) на примере пациента со спленомегалией, асцитом и варикозно расширенными венами [1, 2]. К сожалению, четких статистических данных по данной патологии ни в нашей стране, ни за рубежом нет. По данным аутопсий, в США частота портальных тромбозов колеблется от 0,05 до 0,50% [4, 5]. В европейской популяции ТВВ обусловлено до 10% всех случаев портальной гипертензии, в то же время в развивающихся странах эта цифра достигает 40% [6, 7]. Частота ТВВ у больных циррозом печени (ЦП) и портальной гипертензией, по разным литературным данным, колеблется от 2 до 43% [4, 6]. При пересадке печени частота развития ТВВ варьирует от 2 до 26% [6]. Известно, что ТВВ часто возникает у больных гепатоцеллюлярной карциномой (до 30%). В 50% случаев причина остается неустановленной.
Клиническая картина зависит от локализации и протяженности ТВВ, быстроты его развития и природы предрасполагающего заболевания печени [8]. ТВВ может быть острым или хроническим, но прогноз всегда серьезный и часто неблагоприятный, т. к. его исходами являются либо желудочно-кишечные кровотечения, либо прогрессирование портальной гипертензии [4, 9].
Острый тромбоз быстро приводит к смерти либо вследствие печеночной недостаточности, либо из-за развития инфаркта кишечника (с развитием перитонита, полиорганной недостаточности), либо массивного кровотечения [4, 10]. Сочетание ТВВ с тромбозом брыжеечных вен в основной массе случаев приводит к смерти пациента.
Процесс может быть хроническим, когда заболевание развивается постепенно, т. е. кровоток в воротной вене не прекращается полностью, а лишь несколько снижается из-за тромба, который со временем растет и в последующем закрывает просвет частично или полностью. При хроническом, медленно текущем процессе кровь из органов брюшной полости устремляется в обход воротной вены по портокавальным анастомозам [3, 11]. Хронический ТВВ чаще протекает по типу некоторых других заболеваний органов брюшной полости и трудно диагностируется.
Патогенез ТВВ до конца не ясен. Возникновение ТВВ, как и других венозных тромбозов, может быть объяснено триадой Вирхова, включающей следующие элементы:
– травма стенки вены;
– снижение скорости кровотока в воротной вене: вследствие сдавления сосуда извне опухолью, рубцами, при хронической сердечной недостаточности, констриктивном перикардите, синдроме Бадда – Киари (тромбоз печеночных вен);
– повышение свертываемости крови [10, 12, 13] и/или изменение соотношения ее клеточных элементов (при миелопролиферативных заболеваниях, антифосфолипидном синдроме, после спленэктомии, в послеоперационном периоде, особенно у онкологических больных: сопровождают воспалительные заболевания, отмечаются на фоне приема пероральных контрацептивов) [13–15].
ТВВ может возникать при таких заболеваниях и клинических состояниях, как ЦП, рак печени и поджелудочной железы, аппендицит, хронический панкреатит, хронические воспалительные заболевания кишечника (язвенный колит, болезнь Крона), холангит, при гематологических заболеваниях, обусловливающих повышение свертываемости крови (полицитемия) [6, 7, 15–17], травмы, ожоги, сепсис, беременность / послеродовый период, прием оральных контрацептивов, трансплантация печени. В отдельную группу риска по возникновению ТВВ можно отнести женщин, у которых в последнем триместре беременности или в родах развилась эклампсия, которая сопровождается ДВС-синдромом – свертыванием крови во всех кровеносных сосудах, не исключая воротную вену.
Каждый тромбоз имеет 2 стадии: организация тромба и его реканализация – разрушение части тромба и возобновление кровотока по вене. Исход тромбоза различен и может идти по двум путям. В случае мелкого тромбоза может произойти аутолиз тромба под действием протеолитических ферментов лейкоцитов. Крупные тромбы подвергаются процессу замещения соединительной тканью, т. е. организации тромба. По мере того как тромботические массы замещаются соединительной тканью, в них появляются щели или каналы, выстланные эндотелием, происходит так называемая реканализация тромба. Позже выстланные эндотелием каналы превращаются в сосуды, содержащие кровь, в таких случаях говорят о васкуляризации тромба, что нередко восстанавливает проходимость сосуда для крови. Однако организaция тромба не всегда заканчивается его канализацией и васкуляризaцией. Возможны обызвествление тромба, его петрификация; в венах при этом иногда возникают камни – флеболиты [2, 4, 12, 18, 19].
Из всего вышеизложенного следует, что ТВВ является актуальной медицинской проблемой, т. к. четких алгоритмов диагностики и профилактики данного заболевания в настоящее время не существует, невзирая на мощный арсенал современных диагностических возможностей.
В нашей клинике мы неоднократно лечили и лечим пациентов с различными поражениями печени, однако случай тромбоза портальной вены мы встретили впервые.
Пациент Б.В.Н., 1967 г. р. (49 лет). Поступил в гастроэнтерологическое отделение нашей клиники 25.07.2016 г. с направительным диагнозом: острый панкреатит, болевая форма. Хронический гепатит алиментарно-токсического генеза, высокой степени активности.
Жалобы при поступлении на общую слабость, боли в правом подреберье, околопупочной области, тошноту, потерю аппетита.
История настоящего заболевания: в анамнезе язвенная болезнь 12-перстной кишки, последнее обострение 1 мес. назад, лечился по месту жительства. Внезапное ухудшение самочувствия 15.07.2016 г. после погрешности в диете, когда появились интенсивные боли в эпигастральной области, правом подреберье, общая слабость. Самостоятельно принимал ибупрофен, боли уменьшились. Обратился к врачу. Амбулаторно выполнено УЗИ брюшной полости: признаки реактивного панкреатита. Госпитализирован для уточнения диагноза, лечения.
Эпидемиологический анамнез: в течение 3-х лет в эндемичные районы не выезжал, живет и работает в Москве. Контактов с профессиональными вредностями, химическими и бытовыми ядами не имел, лекарственных препаратов регулярно не принимал. Со слов пациента известно, что ранее злоупотреблял спиртными напитками.
Аллергические реакции, лекарственную непереносимость каких-либо препаратов отрицает.
Перенесенные заболевания: детские инфекции, ОРВИ.
Состояние при поступлении: удовлетворительное. Сознание ясное. Телосложение правильное, нормального питания (рост – 168 см, вес – 85 кг). Т тела – 36,7° С. Кожные покровы смуглые, отмечается иктеричность склер. Выраженные отеки стоп, голеней. Периферических отеков, варикозного расширения вен нижних конечностей нет. Перкуторный звук легочный. В легких дыхание везикулярное, хрипов нет. ЧДД – 16/мин. Область сердца визуально не изменена. Границы относительной тупости – в пределах нормы. Тоны сердца звучные, ритм правильный. ЧСС – 78 уд/мин. АД – 120/80 мм рт. ст. Язык влажный, обложен белым налетом. Живот при пальпации мягкий, болезненный в верхней половине живота, симметричный. Симптомов раздражения брюшины нет. Печень и селезенка не пальпируются.
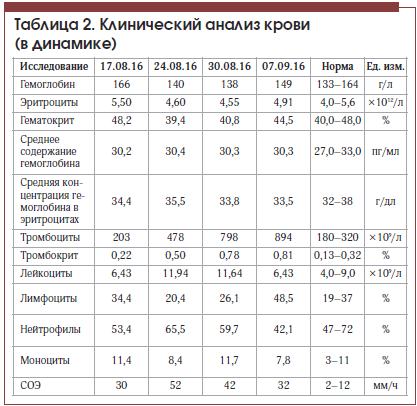
В отделении гастроэнтерологии у пациента выявлены высокий уровень трансаминаз: АлТ – 1098 Ед/л, АсТ – 241 Ед/л, щелочная фосфатаза – 383 Ед/л, ГГТ – 798 Ед/л, повышение уровня общего билирубина до 99,7 мкмоль/л (4 N), прямого – до 81,3 мкмоль/л (13 N). При этом альфа-амилаза – 48 Ед/л (в пределах нормы).
Диагноз пациента при поступлении был неясен. Проведены следующие обследования:
Анализ крови на ВИЧ, RW – не обнаружено.
Анализ крови на гепатиты: HBsAg, антитела к HCV – не обнаружено.
Анализ крови на белок и фракции – в пределах нормы.
Коагулограмма: все показатели коагулограммы при динамическом наблюдении оставались в пределах нормы.
Анализ мочи клинический – в пределах нормы.
Альфа-амилаза мочи: 114 (Норма: 0–700).
ЭКГ: синусовый ритм, ЧСС – 79 уд/мин. ЭОС – нормальная. Замедление внутрижелудочковой проводимости по правой ножке пучка Гиса. Признаки нагрузки на левый желудочек.
На рентгенограмме органов грудной клетки в 2-х проекциях легочные поля обычной пневматизации. Легочный рисунок не деформирован. Корни легких структурны. Тень сердца и аорты обычных формы и размеров. Синусы свободны.
УЗИ органов брюшной полости от 15.08.2016 г. (амбулаторно). Выраженный метеоризм. Желчный пузырь расположен в типичном месте, изогнут в области шейки, размеры – 7,8 × 2,1 см, стенка толщиной 0,3 см, содержимое гомогенное. Гепатикохоледох и внутрипеченочные желчные протоки не расширены. Ткань печени на видимых участках средней эхогенности, однородная, толщина правой доли – 13,2 см. Воротная вена – до 0,9 см. Поджелудочная железа в стандартном срезе, размеры: головка – 2,6 см, тело – 1,6 см, хвост – 2,6 см. Структура ее повышенной эхогенности, неоднородная, с участками сниженной эхогенности.
Заключение
: на момент исследования признаки реактивного панкреатита.
УЗИ органов брюшной полости от 19.08.2016 г. Желчный пузырь расположен в типичном месте, изогнут в шейке, размеры – 10,7 × 3,8 см, стенка толщиной 0,3 см, содержимое гомогенное. Холедох до 0,3 см, содержимое гомогенное. Внутрипеченочные желчные протоки не расширены. Ткань печени на видимых участках умеренно повышенной эхогенности, однородная, контуры ровные, четкие, толщина правой доли – 12,9 см, толщина левой доли – 9,0 см. Воротная вена – до 1,0 см. Желчные протоки долевые – до 0,5 см. Поджелудочная железа в стандартном срезе, форма обычная. Отмечается значительное диффузное утолщение паренхимы: головка – 3,3 см, тело – 1,6 см, хвост – 2,3 см. Контуры неровные, нечеткие, без признаков нарушения целостности. Паренхима гетерогенная, в области головы, по дорсальной поверхности гипоэхогенный участок размерами 2,2 × 1,7 см. Структуры железы дифференцированны, рисунок их нечеткий. Визуализированные фрагменты ГПП не расширены, стенки их с участками повышенной эхогенности. Признаков дополнительных организованных включений в проекции поджелудочной железы не выявлено. Селезенка размерами 8,9 × 3,7 см, структура ее средней эхогенности, однородная. Заключение: на момент исследования признаки диффузных изменений поджелудочной железы, наиболее выраженных в области головки, увеличения размеров желчного пузыря, признаки билиарной гипертензии.
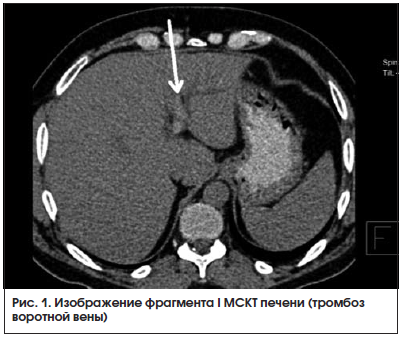
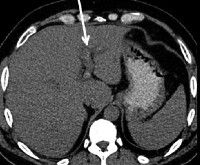
МСКТ органов брюшной полости от 22.08.2016 г. (рис. 1, 2): на серии аксиальных томограмм брюшной полости печень с четким и ровным контуром, в размерах не увеличена (транслобарный размер – 223 мм, КВР правой доли – 143 мм, ККР/ПЗР левой доли – 64/81 мм) и не выходит за край реберной дуги (при исследовании на выдохе). Паренхима печени однородной структуры, плотностью +49 – +53 HU. Внутрипеченочные желчные протоки не расширены. Холедох – до 5,6 мм. Желчный пузырь определяется в типичном месте, стенка его толщиной до 7 мм, слоистой структуры. В просвете пузыря рентгеноконтрастных конкрементов не определяется. Смежная паравезикулярная и параколическая клетчатка вдоль печеночного угла ободочной кишки инфильтрирована. V. porta – 16,3 мм. Начиная от уровня ее деления на правую и левую ветви, в проекции просветов последней и ее сегментарных вен в левой доле печени, на фоне выраженного отека и расширения перипортальных пространств определяются гиперденсные включения (до +81 HU – вероятно, тромботические массы). Между НПВ и портальной веной единичный лимфатический узел однородной структуры и с четкими контурами размерами 24 × 19 мм. Поджелудочная железа с четким и волнистым контуром, толщина ее в области головки 36 мм, тела – 28 мм, хвоста – 24 мм. Дольчатость строения выражена удовлетворительно, практически не определяется на уровне головки железы. Паренхима железы неоднородной структуры, плотностью +25 – +35 HU. Панкреатический проток не расширен (не визуализируется). Парапанкреатическая клетчатка умеренно инфильтрирована, отечна вдоль головки железы. Селезенка обычных размеров, структура ее паренхимы однородная. Надпочечники Y-образной формы, толщина их структур до 4 мм, с наличием участков локального утолщения до 8 мм без изменений характеристик паренхимы слева в области тела. Почки обычных размеров, расположены в типичном месте. Полостная система не расширена. Паренхима однородной структуры, толщиной до 23 мм на уровне средних сегментов, с наличием уплотнений в проекции верхушек пирамидок с обеих сторон. Конкрементов в проекции ЧЛС не выявлено. Паранефральная клетчатка фиброзно перестроена с обеих сторон. Мочеточники осмотрены на протяжении до устьев. Просветы их не расширены. Конкрементов в проекции просветов не определяется. Магистральные сосуды не расширены. Лимфатические узлы не увеличены (единичный узел 10 мм в диаметре определяется парааортально на уровне отхождения ВБА, остальные узлы до 4–6 мм в длиннике, с четким контуром, правильной округлой или овальной формы, однородной структуры и плотности). Свободной жидкости в брюшной полости не выявлено.
Заключение:
КТ-картина не позволяет исключить тромбоз в системе портальной вены. Изменения поджелудочной железы соответствуют острому отечному панкреатиту с преимущественным поражением головки поджелудочной железы. Хронический холецистит. Нодулярная гиперплазия надпочечника слева.

МСКТ органов брюшной полости от 06.09.2016 г. (в динамике на фоне лечения): на серии аксиальных томограмм брюшной полости: печень прежних размеров. Паренхима печени однородной структуры. Смежная паравезикулярная и параколическая клетчатка вдоль печеночного угла ободочной кишки инфильтрирована. V. porta – 15,0 мм, в одной из сегментарных вен левой ветви, на фоне умеренного отека и расширения перипортальных пространств определяется единичное гиперденсное включение (до +48 HU – вероятно, тромботические массы). Между НПВ и портальной веной единичный лимфатический узел однородной структуры и с четкими контурами размерами 21 × 12 мм.
Поджелудочная железа прежних размеров и структуры. Паренхима железы неоднородной структуры. Панкреатический проток не расширен (не визуализируется). Парапанкреатическая клетчатка незначительно инфильтрирована вдоль головки железы. Магистральные сосуды не расширены. Лимфатические узлы не увеличены (единичный узел 10 мм в диаметре определяется парааортально на уровне отхождения ВБА, остальные узлы до 4–6 мм в длиннике, с четким контуром, правильной округлой или овальной формы, однородной структуры и плотности). Свободной жидкости в брюшной полости не выявлено.
Заключение
: КТ-картина тромбоза в системе портальной вены с положительной динамикой. Хронический холецистит. При исследовании в динамике отмечаются значительное уменьшение количества тромботических масс в венах левой ветви портальной вены, умеренное улучшение денситометрических показателей паренхимы печени и поджелудочной железы с уменьшением размеров головки последней.
ЭГДС от 16.08.2016 г. Заключение: небольшая рубцовая деформация луковицы двенадцатиперстной кишки. Поверхностный гастродуоденит.
По результатам обследования в клинике был выставлен следующий диагноз:
Основной: острый панкреатит, болевая форма. Тромбоз воротной вены. Хронический алиментарно-токсический гепатит высокой степени активности.
Осложнения: синдром цитолиза, холестаза.
Сопутствующий диагноз: язвенная болезнь двенадцатиперстной кишки, ремиссия.
Пациент был переведен в хирургическое отделение, где осуществлялось дальнейшее лечение: диета ЩД 5; глюкозо-новокаиновая смесь + спазмолитики в/в капельно, платифиллин 0,2–2 мл в/м, р-р Рингера 500 мл в/в капельно, фамотидин 40 мг в/в капельно, эноксапарин 0,4 мл – по 0,4 мл п/к 2 р./сут, реополиглюкин 400 мл + гепарин 10 000 ЕД в/в 1 р./сут., панкреатин 10 000 Ед по 1 капс. х 3 р./сут.
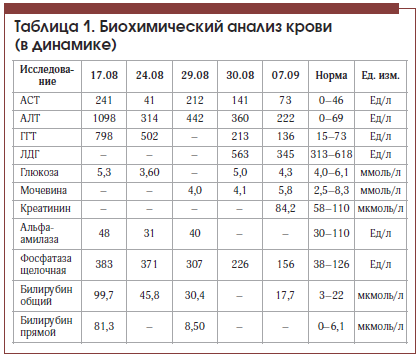
На фоне лечения в состоянии пациента отмечена положительная динамика: регрессировал болевой синдром в животе, уменьшилась общая слабость, улучшился аппетит, в анализе крови отмечено значительное снижение уровня трансаминаз, билирубина (табл. 1), по данным контрольной МСКТ отмечено значительное уменьшение количества тромботических масс в левой ветви портальной вены. Пациент был выписан в удовлетворительном состоянии под наблюдение гастроэнтеролога поликлиники. С учетом показателей тромбоцитов в серии анализов крови (табл. 2) пациенту показана консультация гематолога для уточнения генеза тромбоцитоза и диагноза эритремии.
Анализ данного клинического случая продемонстрировал, что у пациента с острым панкреатитом (с отеком головки поджелудочной железы), алиментарно-токсическим гепатитом, сопровождающимся холестазом, тромбоцитозом неуточненного генеза (возможно, дебют эритремии) развился ТВВ, который, безусловно, осложнил течение заболевания.
Диагностика ТВВ у данного пациента осуществлена благодаря полученным данным МСКТ на 2-й день пребывания в стационаре, что позволило начать адекватную терапию, включавшую антикоагулянты. Информативность КТ при данной патологии доходит до 85% и позволяет получить данные о состоянии стенок сосудов, характере и степени поражения печени (например, с формированием кавернозных узлов), показать протяженность тромбоза [9, 10].
Предотвращение развития ТВВ является сложной и нерешенной до конца проблемой. Профилактика этой крайне опасной патологии состоит в своевременном выявлении и лечении болезней, которые могут стать причиной ее возникновения (хронический панкреатит, хронические воспалительные заболевания кишечника: язвенный колит, болезнь Крона, цирроз и рак печени, поджелудочной железы), что позволит предотвратить неблагоприятные последствия, указанные выше, и снизить летальные исходы.
Источник
Тромбоз воротной вены – это полная или частичная окклюзия ствола воротной вены и ее ветвей тромботическими массами. Патология проявляется абдоминальным синдромом, рвотой, диареей, признаками портальной гипертензии (асцит, спленомегалия, расширение венозных коллатералей), осложняется кровотечением из верхних отделов пищеварительного тракта, инфарктом кишечника и другими состояниями. Основу диагностики составляют методы визуализации – УЗДС, МР- и КТ-ангиография, венография пораженных участков. Лечебная тактика предполагает антикоагулянтную терапию, тромболизис, хирургическую коррекцию.
Общие сведения
Тромбоз воротной вены (пилетромбоз) считается достаточно редким явлением, риск возникновения которого не превышает 1% в общей популяции. Его распространенность среди пациентов с циррозом печени варьируется от 0,6 до 26%, что, по-видимому, связано с различием в критериях выборки и диагностических методах. Заболевание называют причиной 5–10% случаев портальной гипертензии у жителей развитых стран и до 40% – в азиатском регионе (из-за более высокой частоты инфекционной патологии). Распространенность первичного тромбоза у взрослых и детей одинакова. Гендерных отличий в развитии болезни не выявлено, кроме цирротической обструкции, чаще диагностируемой у мужчин.
Тромбоз воротной вены
Причины
Заболевание имеет мультифакторную природу. Тромбоз развивается под влиянием системных и локальных нарушений, участвующих в повреждении сосудистой стенки, усилении коагуляции, замедлении венозного кровотока. Среди наиболее значимых причин отмечают следующие:
- Цирроз печени. Является основным этиологическим фактором, составляя 24–32% случаев тромботической окклюзии. Вероятность тромбоза повышается на поздних стадиях болезни, при необходимости трансплантации органа. Переход цирроза в гепатоцеллюлярную карциному увеличивает частоту внепеченочных пилетромбозов.
- Новообразования. Злокачественные новообразования печеночного или панкреатического происхождения являются причиной 21–24% случаев тромбоза. Развитие патологии опосредовано компрессией или прямой опухолевой инвазией, сопутствующей гиперкоагуляцией, гормональными сдвигами.
- Тромбофилии. Системные нарушения вызваны врожденными дефектами коагуляции – генетическими мутациями (фактора V Лейдена, протромбина, ингибитора активатора плазминогена), дефицитом протеинов C и S, антитромбиновой недостаточностью. К приобретенным факторам относят хроническую миелопролиферативную патологию, антифосфолипидный синдром, пароксизмальную ночную гемоглобинурию.
- Воспалительные заболевания. Патологический процесс может возникать на фоне абдоминальной воспалительной патологии (панкреатита, холецистита, гепатита), инфекционных заболеваний (малярии, брюшного тифа, амебиаза). У детей и новорожденных половина случаев тромбоза приходится на долю омфалита, пупочного сепсиса, аппендицита.
- Травмы и оперативные вмешательства. Воротная вена подвергается повреждению при травмах живота и хирургических вмешательствах на органах брюшной полости (спленэктомии, холецистэктомии, трансплантациии печени). Патология возникает после портосистемного шунтирования, тонкоигольной аспирационной биопсии печени, склеротерапии вен пищевода.
К другим факторам риска тромбоза воротной вены относят беременность, прием пероральных контрацептивов, гиперхолестеринемию. Отмечена роль внутрибрюшной аденопатии, синдрома системного воспалительного ответа. В детском возрасте окклюзия возникает при врожденных аномалиях сосудистой системы (дефектах межжелудочковой и межпредсердной перегородок, деформации полой вены) и желчевыводящих путей. Причина 10–30% тромботических стенозов остается невыясненной.
Патогенез
Исходя из современных представлений, пилетромбоз является результатом системных коагулопатий (наследственных, приобретенных) и действия локальных факторов. Повреждение стенки сосуда опухолью, инвазивными процедурами или травмами характеризуется выработкой цитокинов, активацией тромбоксана A2 и тромбина, усилением адгезии и агрегации тромбоцитов. Венозный застой при наружной компрессии сопровождается гипоксией эндотелия, накоплением активированных факторов свертывания. Все это запускает формирование пристеночного кровяного сгустка с дальнейшим его увеличением.
Сосудистая окклюзия сопровождается портальной гипертензией, что ведет к изменению системной и внутриорганной гемодинамики. Печень теряет около 2/3 своего кровоснабжения, но это компенсируется дилатацией печеночной артерии и быстрым развитием сети коллатералей. Вокруг тромбированной вены формируется кавернома, а сама она превращается в фиброзный тяж. Новообразованные сосуды расположены в пределах желчных протоков и пузыря, поджелудочной железы, антрального отдела желудка, двенадцатиперстной кишки.
Патогенез тромбоза при печеночном циррозе до конца не ясен. Важное значение отводят портальной гипертензии с замедлением кровотока по воротной вене, периферическому лимфангииту, перипортальному фиброзу. Системное шунтирование крови провоцирует гемосидероз, гепатоциты в зонах гипоперфузии подвергаются апоптозу. В тонком и толстом кишечнике выше уровня окклюзии определяются застойные явления, в желудке – гастропатия. Брыжеечная ишемия может привести к переходу тромботического процесса на мезентериальные сегменты.
Классификация
Формальной классификации тромбоза воротной вены не существует. Согласно клиническим рекомендациям по портальной гипертензии, при постановке диагноза учитывают участок тромбоза и его проявления, наличие и характер основного заболевания, степень окклюзии (частичную, полную), вовлеченность внепеченочных сегментов. В зависимости от локализации тромба различают несколько форм патологии:
- Стволовая (трункулярная). Участок окклюзии расположен в стволе воротной вены, дистальнее слияния селезеночной и верхней мезентериальной. Возникает первично или путем распространения из корешкового сегмента.
- Радикулярная (корешковая). Характеризуется поражением корешковых ветвей – селезеночной вены и брыжеечных сосудов.
- Терминальная. Пилетромбоз распространяется на внутрипеченочные разветвления и капилляры, сопровождаясь мелкими или развитыми коллатералями.
Представленная классификация позволяет оценить последствия тромботической обструкции и трудоспособность пациента. При поражении сначала интерстициальных сосудов, а затем крупных стволов констатируют восходящий (первичный) процесс. Мезентериальный тромбоз, возникающий из-за обструкции воротной или селезеночной вен, называют нисходящим (вторичным). В клинической флебологии также различают острую, подострую и хроническую стадии, последовательно сменяющие друг друга.
Симптомы
Клиническая картина тромбоза воротной вены определяется происхождением, степенью, протяженностью, локализацией, темпами нарастания окклюзии, выраженностью коллатералей. Частичное тромбирование протекает бессимптомно, выявляясь лишь при инструментальной диагностике, полной обструкции (90–100% просвета) присуще бурное развитие за несколько суток. Подострая форма прогрессирует на протяжении 4–6 недель, а хронический процесс характеризуется медленным нарастанием симптоматики (от нескольких месяцев до года).
Стволовой тромбоз
Острый стволовой пилетромбоз проявляется резкими болями в правом подреберье и эпигастрии, сочетающимися с метеоризмом, частой рвотой, диареей (нередко с примесью крови). Быстро нарастают признаки портальной гипертензии – расширение подкожных, пищеводных, геморроидальных вен, асцит. Зачастую выявляют желтуху, недостаточность печеночной функции. Общее состояние пациентов быстро становится тяжелым, что в основном обусловлено рецидивирующими кровотечениями из желудочно-кишечного тракта.
Радикулярный тромбоз
Радикулярный тромбоз на уровне селезеночного сегмента начинается остро, с боли в левом подреберье, кровавой рвоты и дегтеобразного стула. Увеличение селезенки и субфебрильная лихорадка сочетаются с обычными размерами печени. В подостром периоде постепенно нарастают спленомегалия, асцит, расширяется венозная сеть на животе. Терминальная форма патологии выявляется только при распространенном поражении – у таких пациентов обычно определяют увеличенную селезенку, широкие подкожные коллатерали.
Хронический тромбоз
Хронический пилетромбоз не имеет специфических проявлений. Отсутствие аппетита и общая слабость – иногда единственные симптомы болезни. У большинства пациентов выявляют подкожные анастомозы, умеренный асцит. В 20–40% случаев патология манифестирует кровотечением из варикозных расширений пищевода. Вялотекущие варианты тромбоза воротной вены характеризуются нерезким болевым синдромом, субфебрилитетом, чувствительностью печении при пальпации. Отмечаются спленомегалия с признаками гиперспленизма, тяжестью в подреберье, исхуданием.
Осложнения
Наиболее опасное следствие острой окклюзии мезентериальных сосудов – инфаркт кишечника с развитием перитонита и полиорганной недостаточности (характерно для 5% случаев). Большинство осложнений длительного пилетромбоза обусловлено портальной гипертензией. Расширение пищеводных вен у многих пациентов сопровождается кровотечением, риск которого в 100 раз выше при циррозе печени. Выраженное портосистемное шунтирование приводит к печеночной энцефалопатии, вторичным изменениям в желчевыводящих путях (портальной билиопатии, холангиопатии). При сохраняющихся факторах риска тромбозы могут рецидивировать, осложняться эмболизацией.
Диагностика
Отсутствие специфических признаков тромбоза, необходимость определения предпосылок, уровня, степени и последствий поражения создают потребность в комплексном обследовании пациента. Основой диагностической программы выступают методы инструментальной визуализации:
- УЗАС воротной вены. Обладая высокой специфичностью (60–100%), признано методом выбора при первичной диагностике. УЗДС определяет неоднородный очаг повышенной эхогенности с нечеткими контурами, частично или полностью перекрывающий сосудистый просвет. Допплеровское картирование дает возможность выявить отсутствие кровотока в вене и ее притоках, наличие портосистемных шунтов, каверноматозную трансформацию.
- КТ и МР-ангиография сосудов. КТ с контрастированием дает точную информацию о состоянии венозных стенок, протяженности тромбированных участков, наличии перивисцеральных коллатералей, варикозных вен в забрюшинном пространстве. Магнитно-резонансную ангиографию используют для выяснения состоятельности портального кровотока, оценки просвета шунтов – ее результаты более надежны, чем УЗДС.
- Портальная венография. Используется в случаях, когда неинвазивными методами подтвердить или исключить тромботическое поражение не удается. Контрастная венография выявляет не только стенозы, но и дефекты наполнения от сдавления извне. Однако при установленной проходимости сосуда в ней нет необходимости.
Проводя диагностику пилетромбоза, врачи-флебологи обращают внимание на показатели коагулограммы (увеличение фибриногена, протромбинового индекса, замедление времени свертывания крови), низкий уровень антитромбина. Выявить варикозно-расширенные вены пищевода позволяет ФГДС, исключить цирроз удается благодаря эластографии и биопсии печени. Дифференциальная диагностика осуществляется с печеночным шистосомозом, тромбозом нижней полой вены, сдавливающим перикардитом, рестриктивной кардиомиопатией.
Лечение тромбоза воротной вены
Задачами лечебной коррекции являются восстановление проходимости сосуда, предотвращение прогрессирования патологии, устранение осложнений венозной гипертензии. Исходя из остроты процесса, возраста пациента, этиологических и прочих факторов, применяют комбинацию консервативных и радикальных методов:
- Антикоагулянтная терапия. Является лучшим способом для реканализации венозного просвета, но единого мнения о ее применении нет. Длительность лечения антикоагулянтами (низкомолекулярными гепаринами, пероральными средствами) у лиц с острым пилетромбозом составляет от 3 до 6 месяцев, а при хроническом решается в индивидуальном порядке.
- Введение тромболитиков. Регионарный тромболизис (введение стрептокиназы, альтеплазы, тенектеплазы) транспеченочным или трансъюгулярным доступом позволяет обеспечить реканализацию, избежав побочных эффектов антикоагулянтной терапии. При острой тотальной или субтотальной окклюзии может выполняться системный тромболизис.
- Хирургические методы. При неэффективности консервативных мероприятий операцией выбора является дистальное спленоренальное шунтирование. В условиях нарушенной проходимости селезеночного участка накладывают мезентерикопортальный или мезентерикокавальный анастомоз с применением сосудистых протезов.
Варикозные расширения пищевода лечат с помощью лигирования, эндоскопической склеротерапии. В ургентных ситуациях при кровотечении могут производить операции азигопортального разобщения (гастротомию с прошиванием нижней трети пищевода, деваскуляризацию желудка). Тяжелый гиперспленизм требует спленэктомии.
Прогноз и профилактика
В целом прогноз при заболевании относительно благоприятный. Сгустки могут подвергаться асептическому аутолизу, организации, васкуляризации. Десятилетняя выживаемость для взрослых достигает 60%, а общий уровень смертности составляет менее 10%. При наличии цирроза и злокачественных новообразований прогноз ухудшается. Иногда тромбы превращаются в эмболы, становятся источником сепсиса. Но своевременное и интенсивное лечение приводит к реканализации сосуда, что сопровождается полным клиническим выздоровлением. Профилактика рецидивов проводится путем назначения антикоагулянтов.
Источник


