Тиоктовая кислота при панкреатите
По материалам статьи “Использование тиоктовой кислоты в комплексном лечении острого алкогольного панкреатита” М.С. Фуныгин, Д.Б. Демин ГБОУ ВПО «Оренбургская государственная медицинская академия» Минздравсоцразвития РФ.

Острый панкреатит — это тяжелая хирургическая болезнь, при которой происходит “самопереваривание” поджелудочной железы собственными ферментами. В течение первых 24-36 часов после начала болезни формируются участки панкреонекроза — омертвевших тканей. Они сдавливают здоровые ткани, нарушая их питание. При этом высвобождается большое количество свободных радикалов, и развивается окислительный стресс. Последний вызывает еще большее повреждение клеток железы, процесс распространяется и очень быстро может перейти на окружающие ткани и брюшную полость. Учитывая механизм повреждения при остром панкреатите, врачи решили использовать препараты с антиоксидантными свойствами, как дополнительный компонент к общепринятым методам лечения острого панкреатита. Одним из самых мощных антиоксидантов является альфа-липоевая кислота.
Почему развивается острый панкреатит?
При остром панкреатите происходит асептическое воспаление, то есть без участия возбудителей инфекции. Выделяют две основные причины болезни — воздействие алкоголя и поражение печени и желчевыводящих путей (билиарный). Более 50%, а по некоторым данным и до 80% случаев, острого панкреатита приходится на алкогольную форму.
Острый алкогольный панкреатит возникает на фоне функциональной недостаточности печени. Поражение печеночных клеток не только снижает способность печени блокировать действие алкоголя, но и выделять антиоксиданты, такие как глутатион, в нужном объеме. Из-за дефицита антиоксидантов организму не удается вовремя остановить разрушение сдавленных, но еще жизнеспособных очагов в поджелудочной железе.
Современные данные указывают, что основным фактором прогрессирования острого панкреатита является именно присоединение окислительного стресса и высокое содержание свободных радикалов в поджелудочной железе. Поэтому требуется профилактическое введение веществ, устраняющих окислительный стресс на ранних сроках острого панкреатита.
Альфа-липоевая кислота: польза при панкреатите
Альфа-липоевая или тиоктовая кислота является сильнейшим антиоксидантом. Кроме самостоятельной блокировки свободных радикалов, она способна восстанавливать уровни других антиоксидантов в крови, таких как токоферол и глутатион. Альфа-липоевая кислота активно используется для лечения сахарного диабета, нейропатии, для профилактики сердечно-сосудистых болезней и осложнений атеросклероза. Она оказывает выраженное противовоспалительное и гепатопротективное действие, помогает бороться с лишним весом.
Целью исследования является анализ эффективности использования альфа-липоевой кислоты в комплексной терапии острого алкогольного панкреатита.
Ход исследования и результаты
Для участия в опыте были отобраны 27 участников. Их выбрали из больных, которые были госпитализированы в хирургическое отделение в течение суток после начала воспаления и у которых был диагностирован острый алкогольный панкреатит. Пациентов разделили на 2 группы. Первая группа из 17 человек получила лечение по стандартной схеме: блокаторы выделения панкреатического сока, внутривенные инфузии, спазмолитики и антибиотики. Больным второй группы дополнительно назначили альфа-липоевую кислоту в дозе 600 мг в сутки внутривенно.
Критерием эффективности считалось прекращение распространения воспаления и его прогрессирования, а также отсутствие признаков присоединения инфекции (асептический путь воспаления).
Для оценки тяжести состояния больных острым панкреатитом использовали шкалу Imrie, которая включала следующие критерии:
— Возраст > 55 лет;
— Лейкоцитоз > 15 x 109/л;
— Глюкоза крови > 10 ммоль/л;
— Мочевина крови > 16 ммоль/л;
— PaO2 (парциальное давление кислорода в артериальной крови) < 60 мм рт.ст;
— Кальций < 2 ммоль/л;
— ЛДГ (лактатдегидрогеназа) > 600 IU/л;
— Печеночные ферменты (АЛТ, АСТ) > 100 IU/л;
— Альбумин < 32 г/л.
Если у больного выявляли три и более критерия из шкалы, то состояние считалось тяжелым. В первой группе тяжелый острый панкреатит был обнаружен у семи больных (это 41,1% участников группы), а во второй — у четырех (40%). Таким образом обе группы до исследования были с почти идентичными параметрами.
Панкреонекроз развился у 11 человек в первой группе, а во второй деструкция наблюдалась у 4 пациентов. Было проведено соответствующее эндоскопическое хирургическое вмешательство для удаления разрушенных тканей.
В первой группе инфицирование наблюдалось у 6 пациентов, во второй после операции никаких инфекционных осложнений не возникло.
В обеих группа наблюдали случаи летального исхода. Причиной смерти двух пациентов стал сепсис (заражение крови), а во второй группе один пациент погиб от недостаточности внутренних органов, при этом панкреатит прогрессировал без инфицирования (стерильный панкреонекроз).
Степень выраженности воспаления при остром панкреатите оценивали с помощью лейкоцитарного индекса интоксикации. Чем выше был индекс, тем тяжелее протекал воспалительный процесс (менее 5 — средняя степень, более 5 — тяжелая). Во второй группе показатель был ниже, и симптомы интоксикации легче поддавались лечению.
Лейкоцитарный индекс интоксикации при остром панкреатите в динамике
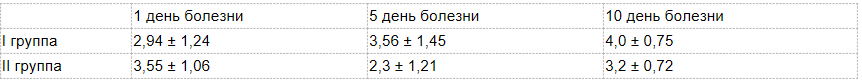
Выводы
Данные проведенного исследования указывают на то, что применение альфа-липоевой кислоты в качестве дополнительного средства при лечении острого алкогольного панкреатита помогает улучшить результаты терапии. Благодаря антиоксидантным свойствам альфа-липоевой кислоты можно прервать прогрессирующую деструкцию тканей поджелудочной железы и предупредить присоединение инфекции. При этом панкреатит протекает в асептической форме, что снижает риск тяжелых осложнений.
Комментарий редактора
При хроническом панкреатите АЛ кислота также может применяться, поскольку его часто сопровождает жировой гепатоз, при котором вопрос свободно-радикального повреждения клеток также является актуальным и польза данного продукта доказана.
Вот несколько цитат из статьи «Применение тиоктовой кислоты в гастроэнтерологии». (Шульпекова Ю.О., Ивашкин, В.Т., Первый МГМУ им. И.М. Сеченова» МЗ РФ, Российский медицинский журнал):
«Для коррекции липидного обмена в гепатоцитах и уменьшения воспалительных явлений в печени могут быть полезны эффекты липоевой кислоты».
«Применение т.н. антиоксидантной схемы (АЛ кислота + гепатопротектор + селен представляет собой недорогой и безопасный метод лечения вирусного гепатита С и торможения прогрессирования вирусного цирроза печени. Подавление воспалительных процессов в печени, антиоксидантный эффект способствуют торможению развития фиброза и снижают риск опухолеобразования».
Статья подготовлена Мариам Арутюнян (врач-кардиолог), специально для Центра Соколинского в Праге
Вы можете нормализовать пищеварение: работу желудка, кишечника, печени, поджелудочной, микрофлору. И жить спокойнее!
Если поймете как связаны между собой эти органы.
Скачайте бесплатно книгу В.Соколинского. Эта система помогла тысячам человек по всему миру!
В соответствии с Законом об охране персональных данных, подтверждаю согласие с получением информационного материала, посредством электронной почты
прочитали
247 477 раз
Источник
Статья опубликована в рамках:
Выходные данные сборника:
ТИОКТОВАЯ КИСЛОТА — ВЛИЯНИЕ НА ЭКСПЕРИМЕНТАЛЬНЫЙ ОСТРЫЙ ПАНКРЕАТИТ
Чегодаева Алена Алексеевна
аспирант, Оренбургская государственная медицинская академия, РФ, г. Оренбург
E-mail: alenaa—med@mail.ru
Солодов Юрий Юрьевич
аспирант, Оренбургская государственная медицинская академия, РФ, г. Оренбург
E-mail:
Неженских Наталья Сергеевна
студент, Оренбургская государственная медицинская академия, РФ, г. Оренбург
E-mail:
THIOCTIC ACID — INFLUENCE ON THE EXPERIMENTAL
ACUTE PANCREATITIS
Alena Chegodaeva
graduate student, Orenburg State Medical Academy, Russia, Orenburg
Yurij Solodov
graduate student, Orenburg State Medical Academy, Russia, Orenburg
Natalia Nezhenskikh
student, Orenburg State Medical Academy, Russia, Orenburg
АННОТАЦИЯ
Цель работы — обосновать эффективность применения тиоктовой кислоты при экспериментальном остром панкреатите. Эффективность применения тиоктовой кислоты определена путём изучения уровня молочной кислоты и малонового диальдегида в сыворотке крови, ткани поджелудочной железы и печени морских свинок. Показано, что применение тиоктовой кислоты позволяет значительно снизить проявления ишемического симптомокомплекса и выраженность свободно-радикальных процессов, что свидетельствует об эффективности данного препарата в лечении экспериментального острого панкреатита.
ABSTRACT
Background — substantiate the efficiency of application of thioctic acid in experimental acute pancreatitis. The efficiency of application of thioctic acid porpoises is determined by studying the dynamics of levels of lactic acid and malondialdehyde in blood serum, tissues of the pancreas and liver. Application of thioctic acid considerably lowers the display of ischemic lesion and expressiveness of free-radical processes that testifies to the efficiency of the given preparation in treatment of an experimental acute pancreatitis.
Ключевые слова: острый панкреатит; тиоктовая кислота; ишемия; липопероксидация.
Keywords: acute pancreatitis; thioctic acid; ischemia; lipoperoxidation.
В настоящий момент наблюдается неуклонный рост заболеваемости острым панкреатитом среди лиц работоспособного населения, что ставит данную проблему значимой не только с медицинской точки зрения, но и социально-экономической [2, с. 35]. Для лечения острого панкреатита (ОП) предложено большое количество методов, но ни один из существующих способов не оказывает достоверного эффективного влияния на течение и исход заболевания [1, с. 67]. Согласно современным представлениям, ведущие и взаимосвязанные звенья в патогенезе острого панкреатита занимают прогрессирующие микроциркуляторные нарушения с ишемическим симптомокомплексом и активация свободно-радикальных процессов [3, с. 43]. Низкая исходная антиоксидантная защита поджелудочной железы и ее угнетение при ОП диктуют необходимость применения антиоксидантных препаратов [6, с. 78].
Одним из мощных антиоксидантов является тиоктовая кислота (ТК), имеющая широкий спектр биологического действия. Это обусловлено ее участием в процессах окислительного декарбоксилирования, облегчая превращение молочной кислоты в пировиноградную с последующим декарбоксилированием последней и купированием метаболического ацидоза (Дж. Бустаманте с соавт., 2001). Многочисленные исследования показали высокую эффективность ТК при лечении диабетической полинейропатии, энцефалопатии, синдрома диабетической стопы, в токсикологии и гепатологии. Имеются единичные исследования по применению ТК при остром экспериментальном панкреатите. Комплексные исследования по обоснованию применения тиоктовой кислоты при остром панкреатите отсутствуют.
Целью исследования являлось определение эффективности применения тиоктовой кислоты в условиях экспериментального острого панкреатита (ЭОП) путём изучения в динамике уровня молочной кислоты (лактата) и одного из вторичных продуктов — малонового диальдегида (МДА) в сыворотке крови, тканях поджелудочной железы (ПЖ) и печени.
Исследование проведено на 95 морских свинках обоего пола массой 600—800 г. Выбор в качестве экспериментальных животных морских свинок обусловлен тем, что они, как и человек, неспособны к эндогенному синтезу аскорбиновой кислоты — одного из ключевых антиоксидантов. Моделировали экспериментальный ОП у 90 особей: в асептических условиях под эфирным наркозом производили верхнесрединную лапаротомию и выделяли ПЖ. В протоковую систему железы вводили 0,5—1,0 мл стерильной гетерожелчи с каплей аутокрови с механическим повреждением ее ткани браншами пинцета. В брюшную полость экспериментального животного для дальнейшего введения препарата ставили эпидуральный катетер.
Животные были разделены на 4 группы. В первую группу вошли 30 животных с ЭОП без применения каких-либо лекарственных веществ. Вторая группа — 30 животных, которым через 2 часа от начала эксперимента и затем ежедневно вводили интраперитонеально 0,9 % раствор NaCl в разовой дозе 6 мл/кг. Третьей группе из 30 животных через 2 часа от начала эксперимента и далее ежесуточно вводили ТК интраперитонеально в разовой дозе 10 мг/кг. Срок наблюдения животных составлял 5 суток. Изучение полученного материала (пробы крови, биоптаты ПЖ и печени) осуществляли через 24, 72 и 120 часов от начала эксперимента. Животные выводились из опыта путем ингаляции летальной дозы эфира и декапитации по 10 особей в каждой группе. 4 группу составили 5 интактных морских свинок, у которых получены нормальные биохимические показатели путём забоя в аналогичных условиях.
Биоптаты отмывали холодным (+4˚С) 0,9 % раствором NaCl и замораживали в жидком азоте, пробы крови центрифугировали с замораживанием полученной сыворотки. Хранение вышеназванных материалов производили в морозильной камере при температуре –18 ˚С.
Определение концентрации МДА проводили набором реактивов для определения ТБК-активных продуктов «ТБК–АГАТ», лактата — энзиматическим колориметрическим методом с использованием стандартного набора реагентов Ольвекс Диагностикум (Kat. No: 019.002).
Результаты и обсуждение. В таблице 1 приведены результаты изучения динамики МДА и лактата в сыворотке крови, в таблице 2 — в ткани ПЖ, в таблице 3 — в ткани печени у обследованных групп животных.
Изучение уровня МДА в сыворотке крови I группы показало превышение нормы через 24 часа в 1,52 раза (р>0,05), через 72 часа — в 1,92 раз (р<0,01), через 120 часов — в 5,86 раз (р<0,01). Сходная картина выявлена в динамике концентрации лактата: она увеличивается соответственно в 2,82, 3,79, 5,94 раз (р<0,01). В тканях ПЖ и печени животных I группы динамика изучаемых показателей аналогична: прогрессирующее нарастание МДА в ПЖ в 3,4 раза (р<0,01), в печени — более, чем в 7 раз (р<0,01). Уровень лактата в ПЖ увеличивается почти в 3 раза (р<0,01), а в печени — более, чем в 3 раза.
Таблица 1.
Динамика уровня лактата и МДА в сыворотке крови
Группы | Срок (часы) | Число особей | МДА мкмоль/л | Лактат ммоль/л |
I. Без лечения | 24 | 10 | 3,56±0,76 | 4,46±0,62 |
(n=30) | 72 | 10 | 4,49±0,17 | 5,99±0,68 |
120 | 10 | 13,72±0,71 | 9,39±0,4 | |
II. 0,9% р-р NaCl | 24 | 10 | 3,86±0,6 | 3,72±0,43 |
(n=30) | 72 | 10 | 4,72±0,37 | 3,35±0,36 |
120 | 10 | 8,49±0,41* | 12,2±0,75* | |
III. Тиоктовая кислота | 24 | 10 | 6,88±0,95** | 6,8±0,77 |
72 | 10 | 4,58±0,55 | 6,13±0,48 | |
(n=30) | 120 | 10 | 4,84±0,45** | 5,91±0,72** |
IV. Норма (n=5) | 5 | 2,34±0,21 | 1,58±0,14 |
Жирный шрифт — разница достоверна по сравнению с нормой;
* — разница достоверна по сравнению с соответствующим показателем в группе без лечения;
** — разница достоверна по сравнению с соответствующими показателями в обеих предыдущих группах
Анализ результатов, полученных в данной группе животных, подтверждает факт выраженной ишемизации панкреатической ткани и печени при ОП, что сопровождается прогрессирующим повышением уровня лактата в сыворотке крови и ткани печени достоверно на всех сроках, а в ткани ПЖ на 3 и 5 сутки. Ишемия ткани ПЖ сопровождается активацией ПОЛ в виде прогрессирующего повышения МДА на всех сроках наблюдения.
Изучение вышеназванных показателей во II группе показало идентичную картину. В сыворотке крови уровень МДА увеличился соответственно в 1,65—3,63 раза (р<0,01 через 72 и 120 часов), лактата — в 2,12-7,72 раза (р<0,02 на всех сроках).
Содержание изучаемых метаболитов в тканях ПЖ и печени у животных II группы аналогично по динамике. Обращает на себя внимание практически отсутствующая достоверная разница соответствующих показателей в I и II группах. Применение физиологического раствора NaCl не меняет существенно течения ОП у экспериментальных животных. Сохраняются нарастающие явления анаэробного гликолиза и активация ПОЛ в сыворотке крови, тканях ПЖ и печени.
Таблица 2.
Динамика лактата и МДА в ткани ПЖ
Группы | Срок (часы) | Число особей | МДА мкмоль/гр. ткани | Лактат ммоль/гр. ткани |
I. Без лечения | 24 | 10 | 2,35±0,22 | 0,92±0,11 |
(n=30) | 72 | 10 | 2,94±0,26 | 1,64±0,21 |
120 | 10 | 6,25±0,09 | 2,31±0,19 | |
II. 0,9% р-р NaCl | 24 | 10 | 2,47±0,89 | 1,17±0,19 |
(n=30) | 72 | 10 | 2,84±0,41 | 1,69±0,09 |
120 | 10 | 5,88±0,45 | 1,89±0,19 | |
III. Тиоктовая кислота | 24 | 10 | 2,09±0,46 | 1,12±0,14 |
72 | 10 | 2,64±0,11 | 1,55±0,12 | |
(n=30) | 120 | 10 | 3,77±0,28** | 1,19±0,18** |
IV. Норма (n=5) | 5 | 1,82±0,27 | 0,76±0,13 |
Жирный шрифт — разница достоверна по сравнению с нормой;
* — разница достоверна по сравнению с соответствующим показателем в группе без лечения;
** — разница достоверна по сравнению с соответствующими показателями в обеих предыдущих группах
При введении ТК также имеет место значительная активация липопероксидации, но она в общем менее выражена, особенно к 5 суткам, когда уровень МДА становится в 1,5—3 раза ниже соответствующих показателей в I и II группах (р<0,05, р<0,01). Повышение содержания лактата выражено менее значительно. В сыворотке крови его уровень достоверно выше нормы, однако к 5 суткам он почти в 2 раза ниже, чем в других группах (р<0,02). В ткани ПЖ содержание лактата повышается (через 24 и 120 часов недостоверно) по отношению к норме, являясь более низким (достоверно через 120 часов), чем в других группах. В печени содержание лактата достоверно выше нормы во все дни наблюдения, но его уровень значительно ниже соответствующих значений в I и II группах, с двукратной разницей через 120 часов (р<0,01).
Таблица 3.
Динамика изучаемых показателей в ткани печени
Группы | Срок (часы) | Число особей | МДА мкмоль/гр. ткани | Лактат ммоль/гр. ткани |
I. Без лечения | 24 | 10 | 3,64±0,15 | 1,43±0,16 |
(n=30) | 72 | 10 | 5,38±0,51 | 2,87±0,17 |
120 | 10 | 6,64±0,25 | 2,37±0,16 | |
II. 0,9% р-р NaCl | 24 | 10 | 3,69±0,23 | 1,36±0,14 |
(n=30) | 72 | 10 | 5,66±0,31 | 1,32±0,21* |
120 | 10 | 4,97±0,26* | 2,25±0,24 | |
III. Тиоктовая кислота | 24 | 10 | 3,98±0,1 | 1,42±0,13 |
72 | 10 | 5,13±0,41 | 1,17±0,16* | |
(n=30) | 120 | 10 | 1,96±0,2** | 1,14±0,12** |
IV. Норма (n=5) | 5 | 0,93±0,1 | 0,74±0,04 |
Жирный шрифт — разница достоверна по сравнению с нормой (р<0,05, р<0,01, р<0,001);
* — разница достоверна по сравнению с соответствующим показателем в группе без лечения;
** — разница достоверна по сравнению с соответствующими показателями в обеих предыдущих группах;
Динамика изучаемых показателей в сыворотке крови и исследуемых тканях практически идентична, что подтверждает закономерность изучаемых процессов.
Таким образом, экспериментальный ОП у морских свинок характеризуется выраженной активацией анаэробного гликолиза, что отражает прогрессирующую ишемию панкреатической ткани. Нарастает содержание продуктов липопероксидации, свидетельствующее об активации процессов ПОЛ. Применение 0,9 % раствора NaCl не приводит к значимым изменениям динамики изучаемых показателей. Введение ТК снижает выраженность ишемических процессов, уменьшаются проявления свободно-радикального окисления.
Выводы.
1. Экспериментальный острый панкреатит у морских свинок характеризуется нарастающим ишемическим поражением панкреатической ткани с активацией свободно-радикальных процессов.
2. Применение тиоктовой кислоты позволяет снизить проявления ишемического поражения ткани поджелудочной железы и выраженность свободнорадикальных процессов при экспериментальном остром панкреатите, что говорит об эффективности данного метода лечения и открывает перспективу для дальнейших исследований.
Список литературы:
1.Брискин Б.С., Рыбаков Г.С. Хирургическое лечение острого панкреатита // Рос. журнал гастроэнтерологии, гепатологии, колопроктологии. — 2000. — № 2. — С. 67—74.
2.Вашетко Р.В. с соавт. Острый панкреатит и травмы поджелудочной железы. СПб., 2000. — 320 с.
3.Владимиров Ю.А. Свободные радикалы и антиоксиданты // Вестник РАМН, — 1998. — № 7. — С. 43—51.
4.Ярема И.В., Колобов С.В., Шевченко В.П. Аутоиммунный панкреатит. М., 2003. — 208 с.
5.Roth E., Manhart N., Wessner B. Assessing the antioxidative status in critically ill patients. //Curr. Opin. Clin. Nutr. Metab. — 2004. — Vol. 7 (2). — P. 161—168.
6.Simovic M.O., Bonham M.J., Abu-Zidan F.M., Windsor J.A. Manganese superoxide dismutase: a marker of ischemia-pereperfusion in injury in acute pancreatitis ? // Pancreas. — 1997. — V. 15 (1). — P. 78—82.
7.Sweiry J.H., Mann G.E. Role of oxidative stress in the pathogenesis of acute pancreatitis // Scand. J. Gastroenterol. — 1996. — № 219. — P. 10—15.
Источник


