Патогенетические механизмы развития острого панкреатита
Панкреатит — это воспаление поджелудочной железы, связанное с повреждением ее экзокринной части. Клинические проявления заболевания варьируют от слабовыраженного и ограниченного процесса до жизнеугрожающего острейшего воспаления, а течение заболевания — от транзиторных атак до утраты функции железы.
При остром панкреатите в случае устранения его причины возможно восстановление ткани поджелудочной железы. При хроническом панкреатите происходит необратимая утрата экзокринной части паренхимы поджелудочной железы.
Острый панкреатит — обратимое повреждение паренхимы поджелудочной железы, связанное с воспалением. Острый панкреатит встречается относительно часто, ежегодная заболеваемость им в западных странах составляет 10-20 случаев на 100 тыс. населения, при этом 80% наблюдений острого панкреатита связано с патологией желчных протоков и алкоголизмом.
Желчные камни обнаруживают в 35-60% наблюдений острого панкреатита, однако только у 5% пациентов с желчекаменной болезнью развивается панкреатит. Доля острого панкреатита, вызванного чрезмерным употреблением алкоголя, варьирует от 65% в США до 20% в Швеции и до 5% и менее в Южной Франции и Великобритании. Соотношение мужчин и женщин в группе с заболеваниями желчных протоков составляет 1:3, а в группе с алкоголизмом — 6:1.

Реже острый панкреатит вызывают:
— обструкция протоков поджелудочной железы. Причинами обструкции (помимо камней) могут быть периампуллярные опухоли (рак поджелудочной железы), холедохоцеле, разделенная поджелудочная железа (спорные данные), сладж-синдром желчного пузыря и паразитарные заболевания (особенно аскаридоз и хлонорхоз, вызываемый С. sinensis);
— лекарственные средства (более 85 наименований, например фуросемид, азатиоприн, 2′,3′-дидезоксииносин, эстрогены);
— инфекции (особенно эпидемический паротит);
— метаболические расстройства (например, гипертриглицеридемия, гиперпаратиреоз), сопровождающиеся гиперкальциемией;
— ишемическое повреждение при шоке, тромбозе сосудов, эмболии и васкулитах;
— травма (тупая травма живота или ятрогенное повреждение во время хирургического вмешательства либо при эндоскопической ретроградной холангиопанкреатографии);
— наследственные дефекты генов, кодирующих синтез панкреатических ферментов и их ингибиторов, включая зародышевые мутации гена PRSS1, кодирующего катионоактивный трипсиноген, и гена SPINK1.
Наследственный панкреатит. У 10-20% пациентов с острым панкреатитом невозможно обнаружить ни один из известных этиологических факторов. Несмотря на то что в таких случаях используют термин «идиопатический панкреатит», новые данные позволяют предположить, что иногда панкреатит имеет генетическую причину. Таким образом, генетические нарушения, ассоциированные с развитием панкреатита, заслуживают особого внимания.
Наследственный панкреатит характеризуется рецидивирующими тяжелыми приступами воспаления поджелудочной железы и обычно манифестирует в детском возрасте. Большинство случаев обусловлено зародышевой мутацией гена PRSS1. Такие мутации нарушают работу основного механизма, препятствующего самоперевариванию ткани поджелудочной железы, путем повреждения участка в гене PRSS1, ответственном за расщепление (инактивацию) трипсина самим трипсином. При наличии такой мутации трипсин становится резистентным к расщеплению другими молекулами трипсина.
И если даже небольшое количество такого трипсина активируется в поджелудочной железе, оно может активировать и другие пищеварительные проферменты, что приводит к развитию панкреатита. Для выработки устойчивого к расщеплению трипсина достаточно даже одного мутантного аллеля гена, т.е. такая форма наследственного панкреатита является аутосомно-доминантной.
Ген SPINK1 кодирует синтез панкреатического секреторного ингибитора трипсина, который подавляет действие трипсина, помогая предотвратить самопереваривание ткани поджелудочной железы активированным трипсином. Наследственные инактивирующие мутации гена SPINK1 также могут привести к развитию панкреатита. Эта форма наследственного панкреатита является аутосомно-рецессивной, т.к. для ее развития должны быть инактивированы оба аллеля гена.
Компьютерная томография: срезы пациентов с острым панкреатитом. Тело и хвост поджелудочной железы увеличены.
Видны следы жидкости в переднем околопочечном пространстве. Обнаружены различия в уменьшении жидкости в левом переднем околопочечном пространстве и подкожном жире.
Найдено крошечное скопление жидкости в теле поджелудочной железы. Жидкость инфильтрирует клетчатку левого переднего околопочечного пространства.
а) Морфология. Морфологическая картина острого панкреатита варьирует от незначительного воспаления и отека до выраженного распространенного некроза и обширных кровоизлияний. Основные виды повреждений:
(1) повышение проницаемости капилляров, приводящее к отеку;
(2) жировой некроз под действием липолитических ферментов;
(3) острое воспаление;
(4) разрушение паренхимы поджелудочной железы под действием протеолитических ферментов;
(5) разрушение кровеносных сосудов с кровоизлияниями.
Степень выраженности каждого из этих повреждений зависит от продолжительности и тяжести патологического процесса.
При легкой форме — остром интерстициальном панкреатите — наблюдаются незначительная воспалительная инфильтрация, интерстициальный отек и небольшие участки жирового некроза в ткани и жировой клетчатке поджелудочной железы. Жировой некроз является результатом ферментативной активности липазы. Высвобождающиеся жирные кислоты, взаимодействуя с ионами кальция, образуют нерастворимые соли, которые придают жировым клеткам вид голубых гранул.
При более тяжелой форме — остром некротизирующем (деструктивном) панкреатите — некрозу подвергаются ацинарная и протоковая ткани и островки Лангерганса. Повреждение сосудов может привести к кровоизлияниям в паренхиму поджелудочной железы. При макроскопическом исследовании в ткани поджелудочной железы выявляются красновато-черные участки кровоизлияний в сочетании с желтовато-белыми участками жирового некроза. Участки жирового некроза также могут быть в сальнике и брыжейке кишки, а также за пределами брюшной полости, например в подкожно-жировой клетчатке.
В большинстве наблюдений в брюшной полости содержится серозная, слегка мутная, с коричневатым оттенком жидкость, в которой можно обнаружить капли жира, образовавшиеся в результате действия ферментов на жировую ткань.
При самой тяжелой форме — геморрагическом панкреатите — некроз паренхимы сопровождается массивными кровоизлияниями в ткань железы.
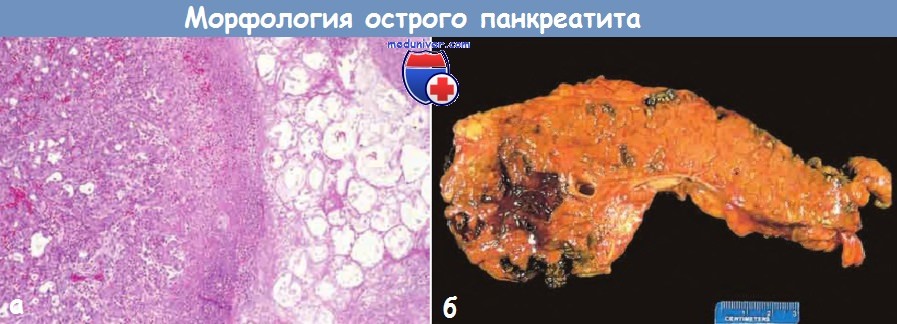
а — Острый панкреатит.
Микроскопическая картина участка жирового некроза (справа)
и очагов некроза паренхимы поджелудочной железы (в центре).
б — Острый панкреатит. Поджелудочная железа рассечена продольно.
На срезе определяются темные участки кровоизлияний в области головки железы,
а также бледная зона жирового некроза в перипанкреатической жировой клетчатке (вверху слева).
б) Патогенез. Морфологические изменения при острых формах панкреатита всегда предполагают самопереваривание ткани поджелудочной железы под действием преждевременно активированных панкреатических ферментов. Эта гипотеза подтверждается наличием наследственных форм панкреатита. Далее основное внимание будет уделено различным формам часто встречающегося приобретенного острого панкреатита.
Как уже обсуждалось, панкреатические ферменты, включая трипсин, синтезируются в форме неактивных проферментов. Если трипсин активируется преждевременно, то он может активировать другие проферменты, такие как профосфолипаза и проэластаза, которые затем повреждают жировые клетки и разрушают эластические волокна кровеносных сосудов соответственно. Трипсин также преобразует прекалликреин в активную форму, таким образом запуская систему кининов, а путем активации фактора XII (фактора Хагемана) — систему коагуляции и систему комплемента. За счет этого происходит усиление воспаления и прогрессирование тромбоза мелких сосудов, что может приводить к гиперемии и разрыву сосудов с уже поврежденной стенкой. Таким образом, аномальная активация трипсиногена является важным пусковым механизмом в развитии острого панкреатита.
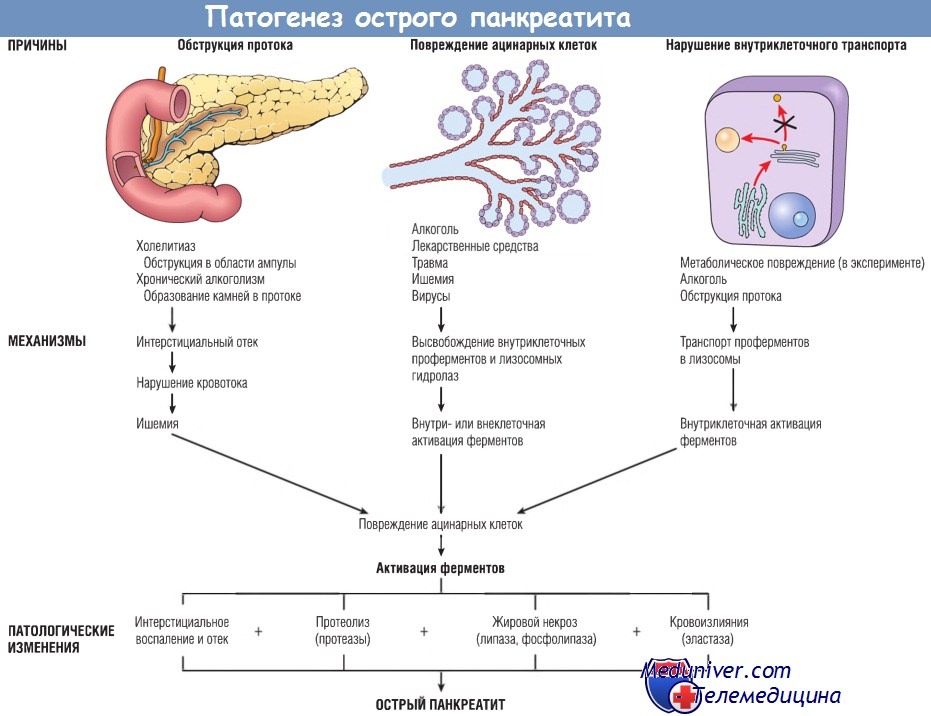
Механизмы, посредством которых происходит преждевременная активация панкреатических ферментов, до конца не ясны, однако есть данные о трех путях такой активации:
1. Обструкция протока поджелудочной железы. Желчные камни и сладж-синдром желчного пузыря в области ампулы фатерова сосочка могут приводить к повышению давления во внутрипанкреатических протоках, что сопровождается накоплением богатой ферментами жидкости в межуточной ткани железы. Поскольку липаза — один из немногих ферментов, секретирующихся в активной форме, это может приводить к появлению очагов жирового некроза. Затем поврежденные ткани, периацинарные миофибробласты и лейкоциты начинают высвобождать провоспалительные цитокины, включая IL-1b, IL-6, TNF, фактор активации тромбоцитов и субстанцию Р, которые запускают очаговый воспалительный процесс и вызывают интерстициальный отек путем повышения проницаемости капилляров. Отек может нарушить локальный кровоток, что станет причиной сосудистой недостаточности и ишемического повреждения ацинарных клеток.
2. Первичное повреждение ацинарных клеток. Этот механизм играет роль в патогенезе острого панкреатита, вызванного некоторыми вирусами (например, вирусом эпидемического паротита), лекарственными средствами и травмой поджелудочной железы, а также в патогенезе панкреатита, возникшего в результате ишемии или шока.
3. Нарушение внутриклеточного транспорта проферментов в ацинарных клетках. В нормальных ацинарных клетках пищеварительные ферменты и лизосомные гидролазы транспортируются разными путями. В эксперименте на животных после повреждения ацинарных клеток панкреатические проферменты попадают во внутриклеточные компартменты, которые содержат лизосомные гидролазы. Там проферменты активируются, разрушают лизосомы и высвобождают активированные ферменты. Роль этого механизма в развитии острого панкреатита у человека пока не ясна.
Алкоголь может вызвать панкреатит посредством нескольких механизмов. Употребление алкоголя приводит к секреции богатого белком панкреатического сока, который способствует отложению плотных белковых пробок и обструкции мелких протоков поджелудочной железы. Кроме того, алкоголь временно повышает экзокринную функцию поджелудочной железы и сократимость сфинктера Одди (мышцы в области ампулы фатерова сосочка), а также оказывает прямое токсическое действие на ацинарные клетки.
в) Клинические признаки. Основным симптомом при остром панкреатите является характерная боль в животе: постоянная, интенсивная, часто иррадиирует в верхние отделы спины, а иногда может сопровождаться болью в левом плече. Выраженность болевого синдрома варьирует от легкого дискомфорта до сильной боли, приводящей к нетрудоспособности. Часто боль сопровождают потеря аппетита, тошнота и рвота. Заподозрить острый панкреатит в качестве основного заболевания можно по повышению уровня амилазы и липазы в плазме крови при исключении других причин боли в брюшной полости.
При остром панкреатите необходима неотложная медицинская помощь. У таких пациентов обычно внезапно развивается картина острого живота. Многие системные проявления тяжелого острого панкреатита являются результатом выброса токсичных ферментов, цитокинов и других медиаторов в системную циркуляцию и молниеносной активации системного воспалительного ответа, проявляющегося в виде лейкоцитоза, гемолиза, ДВС, задержки жидкости, острого респираторного дистресс-синдрома и диффузного жирового некроза. Возможны периферический сосудистый коллапс и шок с развитием острого некроза почечных канальцев.
Лабораторные данные включают резкое повышение уровня амилазы в сыворотке крови в течение первых 24 час с последующим повышением в течение 7296 час уровня липазы. В 10% наблюдений развивается глюкозурия. Гипокальциемия может быть результатом осаждения кальциевых мыл (кальциевых солей высших жирных кислот) в некротизированной жировой ткани. Продолжительная гипокальциемия — неблагоприятный прогностический признак. Помогает поставить диагноз «острый панкреатит» прямая визуализация увеличенной воспаленной поджелудочной железы при рентгенографии.
Ключевым моментом лечения острого панкреатита являются «покой» поджелудочной железы за счет тотального ограничения перорального приема пищи и поддерживающая терапия в виде внутривенного введения жидкостей и обезболивания. Несмотря на то что большинство пациентов с острым панкреатитом полностью выздоравливают, 5% больных с тяжелым острым панкреатитом умирают от шока в течение первой недели заболевания. Наиболее грозные осложнения — острый респираторный дистресс-синдром и острая почечная недостаточность. Другим осложнением является формирование асептического абсцесса и псевдокисты поджелудочной железы. У 40-60% пациентов с острым некротизирующим панкреатитом некротический детрит инфицируется обычно грамотрицательными микроорганизмами желудочно-кишечного тракта, дополнительно осложняя заболевание.
Гистологическая картина острого панкреатита с воспалением вокруг главного протока.
Окраска гематоксилин-эозином (х 80).
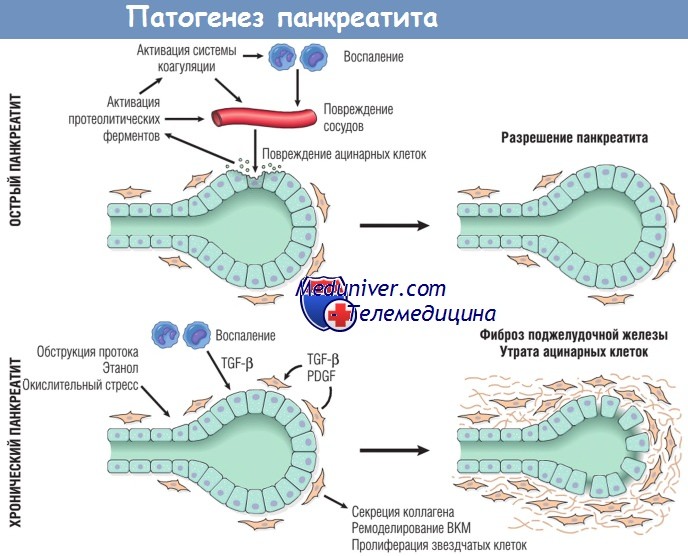
Особенности взаимодействий медиаторов при остром и хроническом панкреатите.
При остром панкреатите повреждение ацинарных клеток приводит к высвобождению протеолитических ферментов,
запускающих каскад реакций, запускающих активацию системы коагуляции, острое и хроническое воспаление, повреждение сосудов и отек.
У большинства пациентов после острого повреждения происходит восстановление ацинарных клеток.
При хроническом панкреатите повторяющиеся эпизоды повреждения ацинарных клеток приводят к выработке фиброгенных цитокинов,
таких как трансформирующий фактор роста р (TGF-p) и тромбоцитарный фактор роста (PDGF), что вызывает пролиферацию звездчатых клеток,
выработку коллагена и ремоделирование внеклеточного матрикса (ВКМ).
В итоге это приводит к необратимой утрате ацинарных клеток, фиброзу и недостаточности поджелудочной железы.
— Рекомендуем ознакомиться со следующей статьей «Механизм развития (патогенез) хронического панкреатита»
Оглавление темы «Патогенез болезней ЖКТ»:
- Механизм развития (патогенез) атрезии желчных протоков
- Механизм развития (патогенез) кисты холедоха
- Механизм развития (патогенез) рака желчного пузыря
- Строение и функции поджелудочной железы
- Механизм развития (патогенез) пороков развития поджелудочной железы
- Механизм развития (патогенез) острого панкреатита
- Механизм развития (патогенез) хронического панкреатита
- Механизм развития (патогенез) кисты поджелудочной железы
- Механизм развития (патогенез) кистозных опухолей поджелудочной железы
- Механизм развития (патогенез) рака поджелудочной железы
Источник
Панкреатит
представляет собой тяжелое заболевание
поджелудочной железы, в основе которого
лежит внутриорганная активация
продуцируемых железой пищеварительных
ферментов и выраженное в различной
степени ферментативное повреждение
ткани (панкреонекроз), с последующим
развитием фиброза, нередко распространяющееся
на окружающие ткани (парапанкреофиброз),
а также осложняемое вторичной инфекцией.
Клинически панкреатит может протекать
в острой и хронической формах, нередко
тесно связанных между собой.
Этиология.
Этиологией
возникновения хронического панкреатита
являются:
1.
Алкоголь, раздражая слизистую оболочку
12 п.к„ не только усиливает продукцию
секретина, панкреозимина, гистамина,
гастрина, а, следовательно, и внешнюю
секрецию ПЖ, но и вызывает рефлекторный
спазм сфинктера Одди, приводящий к
внутрипротоковой гипертензии. Длительное
употребление алкоголя сопровождается
дуоденитом с нарастающей атонией
сфинктера, что приводит к
дуоденопанкреатическому и
билиарнопанкреатическому рефлюксу,
особенно во время рвоты. Имеет значение
и белково-витаминная недостаточность
свойственная хроническому алкоголизму.
Некоторые авторы полагают, что алкоголь
может оказывать и прямое токсическое
воздействие на паренхиму ПЖ. Кроме того,
имеются данные, что хроническая
алкогольная интоксикация изменяет
состав панкреатического сока за счет
увеличения количества белка, лактоферрина
и снижения бикарбонатов и ингибиторов
протеаз, что способствует образованию
конкрементов.
2.
Заболевания желчного пузыря и
желчевыводящих путей, при доминировании
желчнокаменной болезни, включая и
состояние после холецистэктомии.
Сопровождающий эти заболевания
воспалительно-склеротический процесс
в дистальных отделах желчевыводящих
путей приводит к стенозу, либо
недостаточности сфинктера Одди. Спазм
или стеноз сфинктера приводят к
гипертензии в протоковой системе ПЖ и,
как следствие, выходу компонентов
панкреатического сока в паренхиму с
развитием в ней воспалительных и
склеротических изменений. Рефлюкс желчи
при этом не имеет решающего значения,
так как ХП развивается и при раздельном
впадении холедоха и вирсунгиева протока
в 12 п.к. Слизистая оболочка панкреатических
протоков в норме резистентна к действию
желчи, и только при длительной инкубации
желчи в смеси с панкреатическим секретом
или культурой бактерий желчь приобретает
повреждающее действие на ПЖ. В случае
недостаточности большого дуоденального
соска происходит рефлюкс кишечного
содержимого в протоки ПЖ с активацией
протеолитических ферментов, что в
сочетании с гипертензией и оказывает
повреждающее воздействие на паренхиму
органа.
3. Травма ПЖ, в том
числе интраоперационная, В развитии
послеоперационного панкреатита имеет
значение не только прямое воздействие
на ткань железы и ее протоки, но и
деваскуляризация ПЖ,
4.
Заболевания желудочно-кишечного тракта,
особенно 12 п.к.: отек в области Фатерова
соска, затрудняющий отток панкреатического
секрета, дуоденостаз, сопровождающийся
дуоденопанкреатическим рефлюксом;
дивертикулы 12 п.к., которые могут
приводить либо к сдавлению протоков с
последующей гипертензией, либо, в
случае открытия протока в дивертикул-
к дуоденопанкреатическому рефлюксу.
Дуоденит не только поддерживает
воспаление Фатерова соска, но и вызывает
секреторную дисфункцию ПЖ вследствие
нарушения продукции полипептидных
гормонов ЖКТ. Пенетрация язвы 12 п.к.
или желудка в ПЖ чаще приводит к очаговому
воспалительному процессу, а в ряде
случаев — к типичному хроническому
рецидивирующему панкреатиту.
5.
Одностороннее питание углеводной и
жирной пищей при недостатке белков
ведет к резкой стимуляции внешней
секреции с последующим срывом
регенераторных процессов в ПЖ.
Особенно большое значение имеет прием
алкоголя с жирной пищей.
6.
Эндокринопатии и нарушения обмена
веществ:
—
гиперпаратиреоз, который ведет к
гиперкальцисмии и кальцификации ПЖ
/кальций способствует переходу
трипсиногена в трипсин в протоках ПЖ
—
гиперлипидемия, которая ведет к жировой
инфильтрации клеток ПЖ, повреждению
сосудистой стенки, образованию тромбов,
микроэмболии сосудов;
7.
Аллергические факторы. В крови ряда
больных обнаруживаются антитела к ПЖ;
в некоторых случаях отмечается выраженная
эозинофилия (до 30-40% и более). В литературе
описаны случаи появления болевых кризов
при употреблении клубники, и развития
ХП на фоне бронхиальной астмы.
8.
Наследственные факторы. Так известно,
что у детей, родители которых страдают
ХП, повышена вероятность его развития
по аутосомно-доминантному типу.
Подчеркивается более частая встречаемость
ХП у лиц с 0(1) группой крови. В некоторых
случаях это бывает причиной так называемых
ювенильных панкреатитов.
9.
Пороки развития панкреобилиодуоденапьной
зоны: кольцевидная ПЖ, сопровождающаяся
дуоденостазом; добавочная ПЖ с различными
вариантами хода протоков, не обеспечивающими
отток секрета; энтерогенные кисты ПЖ.
10.
Лекарственные препараты: стероидные
гормоны, эстрогены, сульфаниламиды,
метилдофа, тетрациклин, сульфасалазин,
метронидазол, ряд нестероидных
противовоспалительных средств,
иммунодепрессанты, антикоагулянты,
ингибиторы холинэстеразы и другие.
11.
Неспецифический язвенный колит, болезнь
Крона, гемохроматоэ и ряд других
заболеваний, сопровождающихся
склеротическими изменениями в ПЖ без
клинической манифестации, что можно
рассматривать как неспецифическую
тканевую реакцию на токсические или
циркуляторные воздействия. В эту же
группу, вероятно, следует отнести фиброз
ПЖ при циррозах печени.
12.
Инфекционные и паразитарные болезни:
эпидемический паротит, вирусный гепатит,
инфекционный мононуклеоз, брюшной тиф,
туберкулез, сифилис, кишечные инфекции,
амебиаз и т.д., сопровождающиеся межуточным
воспалением ПЖ с последующим ее склерозом.
Патогенез.
Можно считать общепризнанным, что в
основе патогенеза панкреатита у
подавляющего большинства больных лежит
повреждение ткани железы ею же
продуцируемыми пищеварительными
ферментами. В норме эти ферменты
выделяются в неактивном состоянии
(кроме амилазы и некоторых фракций
липазы) и становятся активными лишь
после попадания в двенадцатиперстную
кишку. Большинство современных авторов
выделяют три главных патогенетических
фактора, способствующих аутоагрессии
ферментов в секретирующем их органе:
1)
затруднение оттока секрета железы в
двенадцатиперстную кишку и внутрипротоковая
гипертензия;
2)
ненормально высокие объем и ферментативная
активность сока поджелудочной железы;
3) рефлюкс в
протоковую систему поджелудочной железы
содержимого двенадцатиперстной кишки
и желчи.
Механизмы
патологической внутриорганной активации
ферментов и повреждения ткани железы
различаются в зависимости от причины
панкреатита. Так известно, что алкоголь,
особенно в больших дозах, рефлекторным
и гуморальным путем резко повышает
объем и активность панкреатического
сока. К этому дбавляется стимулирующее
действие алиментарного фактора, поскольку
алкоголики питаются нерегулярно, не
столько едят, сколько закусывают,
принимая много жирной и острой пищи.
Кроме того, алкоголь способствует спазму
сфинктера печеночно-панкреатической
ампулы (сфинктера Одди), вызывает
повышение вязкости панкреатического
секрета, образование в нем белковых
преципитатов, в дальнейшем трансформирующихся
в конкременты, характерные для хронической
формы заболевания. Все это затрудняет
отток секрета и ведет к внутрипротоковой
гипертензии, которая при уровне,
превышающем 35-40 см вод. ст., способна
обусловить повреждение клеток эпителия
протоков и ацинусов и освобождение
цитокиназ, запускающих механизм активации
ферментов. Спазм сфинктера Одди, возможно,
ведет к желчно-панкреатическому рефлюксу
и внутрипротоковой активации ферментов
за счет желчных кислот. Не исключают
также и прямое повреждающее действие
высоких концентраций алкоголя в крови
на железистые клетки.
При
панкреатите, связанном с заболеваниями
желчных путей, главным патогенетическим
фактором является нарушение оттока
панкреатического сока в двенадцатиперстную
кишку, что связано, прежде всего, с
наличием упоминавшегося «общего канала»,
то есть печеночно-панкреатической
(фатеровой) ампулы, через которую отходят
желчные конкременты и куда обычно
впадает главный панкреатический проток.
Известно, что при раздельном впадении
желчного и панкреатических протоков,
а также при отдельном впадении в
двенадцатиперстную кишку добавочного
протока, сообщающегося с главным протоком
поджелудочной железы, билиарный
панкреатит не развивается.
Проходя
через фатерову ампулу, желчные конкременты
временно задерживаются в ней, вызывая
спазм сфинктера Одди и преходящую
протоковую гипертензию, обусловливающую
ферментативное повреждение ткани железы
и, возможно, приступ острого панкреатита,
в ряде случаев протекающий малосимптомно
или же маскирующийся приступом желчной
колики. Повторное «проталкивание»
желчных камней через ампулу за счет
высокого панкреатического и билиарного
давления может привести к травме
слизистой дуоденального сосочка и
стенозирующему панпиллиту, все более
затрудняющему пассаж желчи и
панкреатического сока, а также и повторное
отхождение камней. Иногда наступает
стойкое ущемление желчного конкремента
в ампуле, ведущее к обтурациониой желтухе
и тяжелому панкреонекрозу.
Самостоятельную
роль в патогенезе панкреатита могут
играть также заболевания двенадцатиперстной
кишки, связанные с дуоденостазом и
гипертензией в ее просвете и способствующие
рефлюксу дуоденального содержимого в
панкреатический проток (в том числе
«синдром приводящей петли» после
резекции желудка по типу Бильрот П).
Некоторые авторы указывают и на значение
дивертикулов двенадцатиперстной кишки,
в особенности перипапиллярных, которые
могут обусловливать как спазм, так и
(редко) атонию сфинктера Одди.
Травматический
панкреатит может быть связан как с
прямым, так и с опосредованным воздействием
на поджелудочную железу. При прямой
травме к внутриорганной активации
ферментов ведет механическое повреждение
железы с выделением из омертвевающих
клеток уже упоминавшихся активаторов
(цитокиназ) и последующим развитием в
дополнение к травматическому еще и
ферментативного панкреонекроза. При
эндоскопических вмешательствах на
большом дуоденальном сосочке (РХПГ,
ЭПСТ) часто травмируется слизистая
оболочка фатеровой ампулы и терминального
отдела главного панкреатического
протока. В результате травмы кровоизлияний
и реактивного отека может затрудняться
отток панкреатического секрета и
развиваться протоковая гипертензия.Стенки
протока могут повреждаться и от
избыточного давления при введении
контрастного вещества при РХПГ.
При
опосредованном воздействии случайных
и операционных травм на поджелудочную
железу (травматический шок, кровопотеря,
кардиохирургические вмешательства с
длительной перфузией) повреждение
железистой ткани с высвобождением
активирующих клеточных факторов связано
в основном с микроциркуляторными
расстройствами и соответствующей
гипоксией.
Следует
обратить внимание на еще один важный
аспект патогенеза хронического
панкреатита, недостаточно освещаемый
в литературе. По представлениям
большинства клиницистов панкреонекроз
считается определяющей особенностью
наиболее тяжелых форм острого
деструктивного панкреатита. Однако
повреждение и гибель (омертвение, некроз)
ткани поджелудочной железы под
воздействием внутриорганной активации
и аутоагрессии пищеварительных ферментов
определяет возникновение и течение
любых, в том числе и хронических, форм
рассматриваемого заболевания.
При
хроническом панкреатите, не являющемся
следствием острого, также имеет место
ферментативное повреждение, некробиоз,
некроз и аутолиз панкреатоцитов,
происходящие как постепенно, под влиянием
длительно действующего фактора, так и
остро скачкообразно в период обострений
хронического процесса.
Патологическая
анатомия.
В процессе развития панкреатита в ткани
поджелудочной железы происходит
разрастание соединительной ткани, в
результате чего развивается фиброз и
склероз. В дальнейшем развиваются
обызвествление, нарушение проходимости
панкреатических протоков..
Соседние файлы в предмете Хирургия
- #
- #
- #
- #
- #
- #
- #
- #
Источник

