Острый панкреатит патогенез схема
В
физиологических условиях клетки
поджелудочной железы, продуцирующие
пищеварительные ферменты, защищены от
самопереваривания благодаря наличию
уникальных механизмов. Во-первых, эти
ферменты вырабатываются в виде неактивных
форм. Во-вторых, субклеточные компартменты,
содержащие зимогенные гранулы,
анатомически разделены. В-третьих,
проферменты в секреторных гранулах
упакованы в комплексе с ингибиторами
протеаз и окружены белком паракристаллином.
И, наконец, в-четвертых, в зимогенных
гранулах присутствуют низкие концентрации
ионизированного кальция, а рН внутренней
среды гранул смещено в кислую сторону,
что препятствует преждевременной
активации проферментов в клетках
поджелудочной железы. При несостоятельности
этих механизмов создаются условия для
внутриклеточной активации проферментов
и самопереваривания (аутодигестии)
клеток поджелудочной железы, т.е. для
развития острого панкреатита.
Причины,
вызывающие острый панкреатит, бывают
экзогенные и эндогенные. К экзогенным
причинам относятся:
прием
больших доз алкоголя, особенно при
наличии сопутствующей желчнокаменной
болезни (ЖКБ);вирусы
(эпидемического паротита, Коксаки и
др.);травмы,
хирургические вмешательства, инвазивные
диагностические исследования;прием
некоторых лекарственных препаратов
(диуретиков тиазидового ряда, этакриновой
кислоты, фуросемида; азатиоприна,
вальпроевой кислоты, эстроген-содержащих
препаратов, тетрациклина, сульфаниламидов,
пентамидина и др.);укус
скорпиона.
Острый
панкреатит может быть вызван эндогенными
причинами:
обструкцией
общего желчного протока конкрементами
при ЖКБ, а также рефлюксом желчи в
панкреатические протоки;отеком
или спазмом сфинктера Одди;гиперкальциемией,
например, при гиперфункции паращитовидных
желез;пенетрацией
в поджелудочную железу пептической
язвы.
Дислипопротеинемии
I,
IV,
V
типов, заболевания соединительной ткани
и почечная недостаточность также часто
осложняются развитием острого панкреатита.
Иногда точную причину острого панкреатита
установить не удается, и в этом случае
говорят об идиопатическом остром
панкреатите.
Патогенез
острого панкреатита можно представить
в виде схемы:
действие
патогена
развитие универсальных механизмов
повреждения экзокринных клеток
поджелудочной железы («окислительный»
и «нитрозилирующий» стресс, уменьшение
образования АТФ, увеличение содержания
внутриклеточного ионизированного
кальция)
повреждения структуры внутриклеточных
микротрубочек и микрофиламентов
нарушение выделения зимогенных гранул
в панкреатические протоки
”панкреастаз”
смешивание содержимого гранул лизосом
и зимогенных гранул
внутриклеточная активация трипсиногена
и превращение его в трипсин
запуск каскада активации остальных
проферментов и других биологически
активных веществ.
Трипсин
способен активировать панкреатическую
липазу, которая разрушает мембраны
клеток поджелудочной железы и вызывает
их жировой некроз. Активация фосфолипазы
А2 (ФЛ А2) под влиянием трипсина приводит
к расщеплению лецитина клеточных мембран
до лизолецитина, лизолецитина, обладающего
мембранотоксическим действием и
усугубляющим выраженность повреждения
клеток поджелудочной железы. Трипсин
также способствует превращению
панкреатической проэластазы в активную
эластазу. Последняя нарушает целостность
кровеносных сосудов поджелудочной
железы и увеличивает их проницаемость,
способствуя тем самым усилению отека
поджелудочной железы. Кроме того, под
влиянием трипсина из калликреиногена
образуются большие количества калликреина
и брадикинина. Эти медиаторы воспаления
способны активировать эндотелиоцитарную
конституциональную NO-синтазу
кровеносных сосудов не только поджелудочной
железы, но и всего организма. Увеличение
образования оксида азота в кровеносных
сосудах ведет к снижению их тонуса,
увеличению их проницаемости, отеку
поджелудочной железы и артериальной
гипотензии. Брадикинин, взаимодействуя
с соответствующими рецепторами, вызывает
боль, которая при остром панкреатите
может быть нестерпимой; некоторые
пациенты характеризуют ее как «чувство
вбитого кола в подреберье». Трипсин
также способствует превращению
протромбина в тромбин, что, совместно
с активацией тромбоцитов провоспалительными
цитокинами и другими медиаторами
воспаления приводит к развитию
ДВС-синдрома.
Попадание
содержимого секреторных гранул в
интерстиций поджелудочной железы
хемоаттрактантное действие компонентов
гранул
привлечение в очаг воспаления клеток
лейкоцитарного ряда
активация нейтрофилов и макрофагов
выделение в интерстициальное пространство
АФК и АФА, а также протеаз – катепсинов
B,
D,
G, коллагеназы и эластазы; образование
макрофагами провоспалительных цитокинов
ФНО-,
ИЛ-6, ИЛ-8
амплификация локального воспаления
развитие системного воспалительного
ответа.
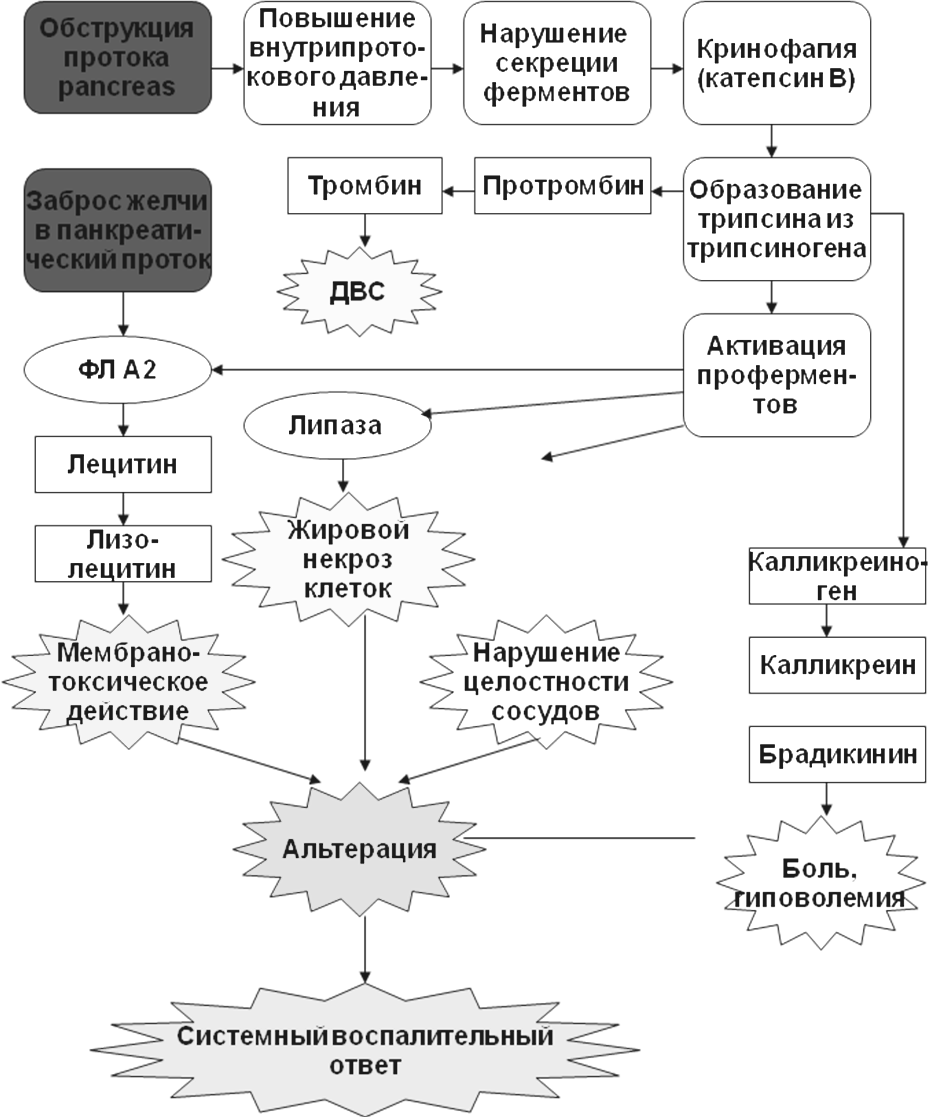
Рис.
Патогенез острого панкреатита
Существуют
некоторые особенности механизмов
возникновения острого панкреатита при
действии различных патогенов. Так, одна
из наиболее частых причин острого
панкреатита – употребление чрезмерных
количеств алкоголя. В этом случае
развитию панкреатита способствуют:
стимуляция этанолом внешнесекреторной
функции поджелудочной железы; спазм
или острый отек сфинктера Одди под
действием этанола, приводящие к увеличению
давления в протоках поджелудочной
железы; повышение активности окислительного
пути деградации этанола в поджелудочной
железе и гибель части ее паренхиматозных
клеток в результате «окислительного»
стресса. При ЖКБ могут наблюдаться спазм
или отек сфинктера Одди, либо заброс
желчи и содержимого 12-перстной
кишки
в протоки поджелудочной железы. При
этом внутриклеточной активации
проферментов предшествует активация
фосфолипазы А2.
Морфологически
острый панкреатит может проявляться
острым отеком поджелудочной железы,
геморрагическим воспалением,
панкреонекрозом и гнойным воспалением.
Достаточно часто при остром панкреатите
пациенты погибают из-за развития
системных осложнений.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Классификация
Схема патогенеза гемодинамических нарушений при остром панкреатите
Схема патогенеза острого панкреатита
МКБ 10
Классификация
ЗАБОЛЕВАНИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Поджелудочная железа филогенетически и анатомически тесно связана с печенью, двенадцатиперстной кишкой. Раncreas — «поддон для плоти», «подушка для желудка». Она расположена поперек на уровне I-II поясничных позвонков (справа- головка и крючковидный отросток прилежат к двенадцатиперстной кишке, слева – хвост достигает ворот селезенки). Левее головки и позади нее проходят верхнебрыжеечные сосуды, здесь железа становится тоньше. Это место называют перешейком, который продолжается левее в тело и хвост.
Спереди и снизу тело и хвост железы покрыты брюшиной, иногда называемой «капсулой» от которой в железу входят соединительнотканные перегородки, разделяющие паренхиму железы на дольки, которые делятся на группы клеток, составляющих ацинусы. Образуясь из двух зачатков дорзаль-ного и вентрального, поджелудочная железа дренируется через два протока, которые соединяются в области головки. В дальнейшем Вирсунгов проток впадает в ампулу большого дуоденального соска (раpilla vateri), а Сантаринов (d. Santorini) на 2 см выше впадает в двенадцатиперстную кишку самостоятельно.
В 7% случаев протоки не соединяются, в таких случаях d. Santorini дренирует тело и хвост, а Вирсунгов проток только головку и крючковидный отросток.
Поджелудочная железа выделяет в кровь гормоны (инсулин, глюкагон, соматостатин и некоторые полипептиды, ингибитор протеаз).
В просвет 12-перстной кишки выделяется большое количество бикарбонатов (до 2000 ml) и панкреатические ферменты: трипсин, имотрипсин, липаза, амилаза и др. Несмотря на то, что амилаза также образуется в слюнных железах, в молочных при лактации, в печени, маточных трубах, определение концентрации амилазы в крови и моче — наиболее распространенный тест при любой патологии поджелудочной железы.
I. Пороки развития:
1. Аномалия положения
2. Добавочная железа
3. Кольцевидная железа
II. Повреждения:
1. Закрытые
2. Открытые
Ш.Панкреатиты:
1. Острые
2. Хронические
IV. Опухоли:
1. Доброкачественные
2. Злокачественные
V. Кисты:
1. 1.Ложные
2. Истинные
VI. Свищи:
1. Наружные
2. Внутренние
| К85 | Острый панкреатит |
| К86 | Другие болезни поджелудочной железы |
| К86.0 | Хронический панкреатит алкогольной этиологии |
| К86.1 | Другие хронические панкреатиты |
| К86.2 | Киста поджелудочной железы |
| К86.3 | Ложная киста поджелудочной железы |
| К86.8 | Другие уточненные болезни поджелудочной железы |
| К86.9 | Болезнь поджелудочной железы неуточненная |
| К87* | Поражения желчного пузыря, желчевыводящих путей и поджелудочной железы при болезнях, классифицированных в других рубриках |
| К87.0* | Поражение желчного пузыря и желчевыводящих путей при болезнях, классифицированных в других рубриках |
| К87.1* | Поражение поджелудочной железы при болезнях, классифицированных в других рубриках |
Острый панкреатит – воспалительно-некротическое поражение поджелудочной железы, развивающееся в результате ферментативного аутолиза или самопереваривания.
Среди острых хирургических заболеваний органов брюшной полости панкреатит занимает по частоте третье место после острого аппендицита и острого холецистита. Женщины страдают острым панкреатитом в 3-4 раза чаще, чем мужчины.
Причины, вызывающие острый панкреатит:
1. Билиарно-панкреатический рефлюкс, обусловленный блокадой устья фатерова сосочка.
2. Блокада оттока панкреатического сока.
3. Повреждение ацинозных клеток поджелудочной железы при закрытой и открытой травме живота, оперативных вмешательствах, экзогенных интоксикациях, алиментарных нарушениях (алкоголь).
4. Острые расстройства кровообращения в железе (перевязка, тромбоз, эмболия, сдавление сосудов и др.)
5. Дуодено-панкреатический рефлюкс.
6. Эндокринные нарушения (гиперпаратиреоз, беременность, длительное лечение кортикостероидами, выраженная гиперлипидемия).
7. Аллергические и аутоиммунные компоненты. Меders и Brown назвали 140 причин панкреатита.
(принята на V Всероссийском съезде хирургов в 1978 году)
1. Отечный панкреатит.
2. Жировой панкреонекроз.
3. Геморрагический панкреонекроз.
I стадия – шока, гемодинамических нарушений 1-3 суток.
II стадия – функциональной недостаточности паренхиматозных органов (5-7 сутки).
III стадия – постнекротических и гнойных осложнений (2-4 недели).
Дата добавления: 2014-02-03; просмотров: 2398; Опубликованный материал нарушает авторские права? | Защита персональных данных | ЗАКАЗАТЬ РАБОТУ
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студента самое главное не сдать экзамен, а вовремя вспомнить про него. 9967 — | 7475 — или читать все…
Читайте также:
Источник
Острый панкреатит—
острое асептическое воспаление
поджелудочной железы, основу которого
составляют процессы аутоферментативного
некробиоза и некроза органа.
Этиология и
патогенез:
Основной этиологический фактор-
заболевания
внепеченочных желчных путей.
Анатомическая и функциональная общность
панкреатобилиарной системы обусловливает
частое развитие острого панкреатита
при ЖКБ, холедохолитиазе, стриктуре,
спазме или воспалении большого
дуоденального сосочка, дискинезии
желчных путей раздичной природы. В этих
условиях нарушается отток панкреатического
секрета по внепеченочным желчным путям
и протоковой системе поджелудочной
железы, развивается билиарно-панкреатический
или дуоденально-панкреатический рефлюкс,
а также внутрипротоковая гипертензия.
Вторая причина-алкоголизм—
ведет к нарушению дренажной функции
панкреатических и желчных протоков,
т.к. алкоголь стимулирует секрецию,
которая увеличивает вязкость секрета
и повышение внутрипротокового давления.
Повреждение
железы при травме или хир. вмешательства.
При заболеваниях
12-перстной кишки
нарушение эвакуации из кишки, повышение
внутриполостного давления приводят к
формированию дуоденально-панкреатич
рефлюкса и внутрипротоковой гипертензии
с возникновением панкреатита.
Лекарственные
средства(фуросемид,
индометацин), При нарушениях
нейро-гуморального и висцерального
взаимоотношений,
системного метаболизма при гиперлипидемии,
СД, СПИДе. Комбинация нескольких пусковых
факторов приводит к повреждения ацинарной
клетки. Патогенез:
Происходит слияние зимогенных гранул
и лизосомных гидролаз, происходит
активация проферментов и выход протеаз
в интерстиций поджел. Железы, в следствие
чего происходит ее аутокаталитичесое
переваривание (трипсиноген-трипсин).Активированные
ферменты поджел. Железы- первичные
факторы агрессии,
оказывают местное действие. Фосфолипаза
А разрушает мембраны клеток, липаза
гидролизует внутрикл. триглицериды до
ж.к., которые соединяясь с кальцием,
образуют элементы структуры жирового
некроза в поджел. железе. Трипсин и
химотрипсин осуществляют протеолиз
белков тканей, эластаза разрушает стенку
сосудов и межтканевые соединительнотканные
струкутуры, что приводит к развитию
геморрагического некроза. Трипсин
активирует калликреин-кининовую систему
с образование вторичных факторов
агрессии—
брадикинина, гистамина, серотонина, что
сопровождается увеличением сосудистой
проницаемости, нарушениями микроцеркуляции,
формированием отека в зоне поджел.
железы. К
факторам агрессии третьего порядка
относят синтез медиаторов воспаления(
интерлейкины 1,6,8,10, факторы некроза
опухоли, лейкотриены и т.д.). В ранние
сроки концентрация всех медиаторов
увеличивается в поджел. железе, печени,
легких, селезенке, а их дисбаланс
определяет механизм развития локальной,
органной и системногй восп. реакции и
полиорган. недост. Ферменты, цитокины
и метаболиты, образующиеся в поджелуд.
железе поступают в воротную вену или
по грудному лимф. протоку в системный
кровоток с развитием панкреатогенной
токсинемии. Первые
органы-мишени: печень, легкие, сердце,
мозг и почки.
Итогом является возникновение выраженных
расстройств их функций и развитие
панкреатогенного шока. Также
важную роль играет токсемия бактериальной
природы. При
остром панкреатите транслокация
эндогенной микрофлоры и эндотоксина
грамотриц. бактерий кишечника происходит
в условиях нарушения барьерной функции
ЖКТ, ретикулоэндотелиальной системы
печени и легких, в следствие чего
возникают возникают гнойно-септические
осложнения.
Патоморфология:
Отечный
панкреатит(отек
ткани поджел. железы, уплотнение,
микроучастки жир.некроза). Жировой
панкреонекроз(
увеличение железы, отек, исчезновение
дольчатости ее структуры, наличие очагов
и зон стеатонекроза, участков геморрагий
в железе. В б.п. появл. серозный прозрачный
экссудат). Геморрагический
панкреонекроз(в
паренхиме железы и окружающих тканях
обширные участки кровоизлияний , зоны
некроза, стеариновые пятна. В б.п. большое
количество геморрагического выпота).
Это асептическая фаза, при присоединении
инфекции – возникает инфицированный
панкреонекроз.
Классификация:
Отечный панкреатит
Стерильный
панкреонекроз: — по распространенности
поркажения: ограниченный и распространенный
— по характеру
поражения: жировой, геморрагический,
смешанный
Инфицированный
панкреонекроз.
Клиническая
картина:
внезапная боль
в вечернее
или ночное время суток после употребления
жирных блюд, аклкоголя. Локализуется в
эпигастральной области. Рвота—
возникает одновременно с болями,
многократная, не приносит облегчения.
Провоцируется приемом пищи и воды.
Температура
в начале заболеания- субфебрильная, при
развитии инфицированной формы-
гектическая. Больной обеспокоен . Важным
признаком является цианоз
лица и конечностей.
Цианоз в виде фиол. пятен на лице (симптом
Мондора), пятна цианоза на боковых
стенках живота( Грея Тернера), цианоз
околопупочной области( Грюнвальда).
Живот вздут
в верхних отделах. Резко чувствителен.
Пальпация поясничной области резко
болезненна( Мейо-Робсон). Ригидность
мышц в зоне повышенной чувствительности.
Поперечная болезенная резистентность
передней брюш. стенки в проекции поджел.
железы (симптом Керте). Невозможность
определения пульсации брюшного отдела
аорты и-за
увеличения размеров поджел. железы
(Воскресенский).
Диагностика:
Активность панкреатич. ф-тов в крови –
альфа-амилаза и липаза. Лейкоцитоз
12-15*10^9/л, активность фосфолипазы А,
трипсин-активированных пептидов,
интерлейкинов 6,8. УЗИ, КТ, лапароскопия.
Лечение:
Консервативное—
адекватная инфузионная терапия-основа
лечения. Переливают изотонич р-ры и
препараты калия хлорида при гипокалиемии.
коллоидные растворы при дифиците ОЦК,
проводят мероприятия для подавления
функц. активности поджелудочной железы,
с целью снижения кислотности желудочного
секрета назначают щелочное питье и
Н2-блокаторы желуд. секреции. С целью
системной детоксикации исп.: пзамофере,
ультрафильтрация крови. Антибиотики(
цефалоспорины 3и 4 поколения, фторхинолоны).
Хирургическое—
Резекция
в случае полного некроза. Абдоминизация—
направлена на декомпрессию парапанкреальной
клетчатки, адекватную эвакуацию
панкреатогенного и инфицированного
выпота из забрюшинного пространства.
С этой целью рассекают брюшину по нижнему
и верхнему краям в области тела и хвоста
органа, выделяют железу. Некроэктомия—
удаление некротизированных тканей.
Соседние файлы в папке экз
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
По данным В.С. Савельева и соавт., 2001
Стимуляция секреции + нарушение оттока
↓
Повреждение клеток
↓
Высвобождение цитокиназы
↓
Переход трипсиногена в трипсин:
↓
| Активация проэнзимов (в т.ч. липаз) | Выделение кининов из кининогена | Активация фосфолипазы А |
| Расщепление клеточных жиров на глицерин и желчные кислоты | Образование брадикинина, гистамина, серотонина | Высвобождение из мембран клеток токсических лизолецитина и лизокефалина |
| Образование жировых некрозов | Повышение проницаемости капилляров, нарушение микроциркуляции, ишемия, гипоксия, ацидоз, боль и генерализованная вазодилатация |
Основу патогенеза острого панкреатита составляют процессы местного и системного воздействия панкреатических ферментов и цитокинов различной природы. Ферментную теорию с основной ролью трипсина в патогенезе заболевания считают ведущей. Комбинация нескольких пусковых факторов в рамках полиэтиологичности острого панкреатита — основной момент внутриацинарной активации протеолитических ферментов и аутокаталитического переваривания поджелудочной железы. В цитоплазме ацинарной клетки наблюдается слияние зимогенных гранул и лизосомальных гидролаз («колокализационная теория»), вследствие которого активируются проферменты с последующим выходом протеаз в интерстиций поджелудочной железы. Активация трипсиногена и переход его в трипсин — мощный активатор всех остальных проэнзимов с формированием каскада тяжёлых патобиохимических реакций. Принципиально важным в патогенезе заболевания представляют преждевременную активацию ферментных систем, причём ранний механизм активации связан с повреждением клеточных мембран и нарушением трансмембранных взаимосвязей.
Один из реально существующих механизмов патогенеза панкреонекроза при повреждении ацинарной клетки — изменение концентрации ионов кальция в клетке и за её пределами, что приводит к активации трипсина. При увеличении концентрации ионов кальция в клетке инициируется внутриклеточный синтез фактора активации тромбоцитов (главного медиатора воспаления).
Другие механизмы аутоактивации ферментных систем в поджелудочной железе: нарушение равновесия в системе «фермент-ингибитор» или дефицит ингибиторов трипсина (альфа-1-антитрипсина или альфа-2-макроглобулина), развивающийся на фоне мутации соответствующего гена.
Трипсин — первичный активатор каскада тяжёлых патобиохимических реакций, но выраженность патологических реакций обусловлена действием интегральной совокупности всех ферментных систем поджелудочной железы (трипсина, химотрипсина, липазы, фосфолипазы А2, эластазы, карбоксипептидазы, коллагеназы и т.д.).
Активированные ферменты поджелудочной железы выступают в качестве первичных факторов агрессии, оказывают местное действие, поступают в забрюшинное пространство, брюшную полость, по воротной вене — в печень, по лимфатическим сосудам — в системный кровоток. Фосфолипаза А2 разрушает мембраны клеток, липаза гидролизует внутриклеточные триглицериды до жирных кислот, которые, соединяясь с кальцием, образуют элементы структуры жирового (липолитического) некроза в поджелудочной железе, клетчатке забрюшинного пространства и брюшине. Трипсин и химотрипсин вызывают протеолиз белков тканей, эластаза разрушает стенку сосудов и межтканевые соединительнотканные структуры, что приводит к развитию геморрагического (протеолитического) некроза. Формирующиеся очаги некробиоза, некроза с перифокальной демаркационной зоной воспаления в поджелудочной железе и забрюшинной клетчатке первично асептические.
Важное звено патогенеза острого панкреатита — активация трипсином калликреин-кининовой системы с образованиемвторичных факторов агрессии: брадикинина, гистамина, серотонина. Это сопровождается увеличением сосудистой проницаемости, нарушениями микроциркуляции, формированием отёка в зоне поджелудочной железы и забрюшинном пространстве, повышенной экссудацией в брюшную полость.
К факторам агрессии третьего порядка, участвующим в патогенезе местной и системной воспалительной реакции, нарушений микроциркуляции и системной гемодинамики, сердечной и дыхательной недостаточности, относят синтез мононуклеарными клетками, макрофагами и нейтрофилами различных медиаторов воспаления (цитокинов): интерлейкинов 1, 6 и 8, фактора некроза опухолей, фактора активации тромбоцитов, непанкреатической формы фосфолипазы А2, простагландинов, тромбоксана, лейкотриенов, оксида азота.
К провоспалительным цитокинам относят: фактор некроза опухолей, интерлейкины 1-бета и 6, а к противовоспалительным — интерлейкины 1 и 10. В начале заболевания концентрация всех медиаторов воспаления в поджелудочной железе, печени, лёгких, селезёнке и системной циркуляции увеличивается, что объясняет механизмы развития локальной, органной и системной воспалительной реакции.
Ферменты, цитокины и метаболиты различной природы, образующиеся при остром панкреатите в поджелудочной железе, забрюшинном пространстве, брюшной полости и просвете желудочно-кишечного тракта, быстро поступают в портальный кровоток и по грудному лимфатическому протоку — в системную циркуляцию с развитием панкреатогенной токсинемии. Первые органы-мишени на их пути из забрюшинного пространства к органам экстраабдоминальной локализации — печень и лёгкие, сердце, мозг и почки. Итог мощного цитотоксического действия этих биохимических соединений в начале заболевания — развитие панкреатогенного шока и полиорганных нарушений, определяющих степень тяжести состояния больного острым панкреатитом.
В патогенезе системных нарушений еще до развития септических осложнений имеет значение токсинемия бактериальной природы и, прежде всего, липополисахарид клеточной стенки грамотрицательных бактерий (эндотоксин), продуцируемый в просвете желудочно-кишечного тракта микрофлорой кишечника. При остром панкреатите перемещение эндогенной микрофлоры и эндотоксина грамотрицательных бактерий кишечника происходит в однотипных условиях функциональной (реже морфологической) несостоятельности метаболической и барьерной функции желудочно-кишечного тракта, ретикулоэндотелиальной системы печени и лёгких.
Перемещение эндогенной микрофлоры из желудочно-кишечного тракта в ткани поджелудочной железы и забрюшинного пространства — основное звено патогенеза деструктивного панкреатита. Этот процесс — связующее звено между начальной, «ранней» (доинфекционной), и последующей, «поздней» (септической), фазами острого панкреатита.
В патогенезе острого панкреатита выделяют две основные фазы. Первая фаза обусловлена формированием системной реакции в течение первых суток от начала заболевания, когда воспаление, аутолиз, некробиоз и некроз поджелудочной железы, забрюшинной клетчатки носит асептический характер. В этих условиях в первую неделю заболевания в зависимости от степени выраженности патоморфологических нарушений возможно формирование следующих форм острого панкреатита:
при некробиозе, воспалении и отграничении процесса развивается острый интерстициальный панкреатит (отёчная форма);
при жировом или геморрагическом некрозе — стерильный панкреонекроз (некротический панкреатит).
Тяжесть состояния больного острым панкреатитом обусловлена патоморфологией заболевания и панкреатогенной токсинемией, панкреатогенным шоком и полиорганной недостаточностью. Своевременными лечебными мероприятиями патологический процесс можно купировать на этапе интерстициального панкреатита, тогда как в обратной ситуации он переходит в панкреонекроз.
При прогрессировании заболевания с исходом в панкреонекроз закономерен переход патологического процесса во вторую (септическую) фазу острого панкреатита, связанный с инфицированием зон некроза различной локализации на 2-3-й неделе заболевания. В этих условиях происходит повторная активация и репродукция аналогичных первой фазе медиаторов, триггер которых — токсины микроорганизмов, колонизирующих зоны некроза. В инфекционную фазу заболевания порочный круг патологических реакций составляет качественно новый этап формирования разнообразных инфицированных форм панкреонекроза и абдоминального сепсиса с септическим шоком и полиорганной недостаточностью. Средняя частота инфицирования при панкреонекрозе составляет 30-80%, что определяется распространённостью панкреонекроза, сроками от начала заболевания, характером консервативной терапии и тактикой хирургического лечения. Развитие инфекции при панкреонекрозе необходимо рассматривать как важный этап эволюции патоморфологического процесса.
Существует прямая зависимость между степенью распространённости некротического поражения и вероятностью инфицирования. Инфицированные формы некроза выявляют у каждого четвертого больного на первой неделе заболевания; практически у половины пациентов, страдающих панкреонекрозом на второй неделе; у каждого третьего больного деструктивным панкреатитом в период третьей и четвёртой недель от начала заболевания.
Наиболее частые возбудители панкреатогенной инфекции: кишечная палочка (26%), синегнойная палочка (16%), стафилококки (15%), клебсиелла (10%), стрептококки (4%), энтеробактер (3%) и анаэробы. Грибковая инфекция развивается спустя 2 нед и больше от начала развития панкреонекроза, что обусловлено длительностью предшествующей антибактериальной терапии.
Инфицирование изначально стерильных зон панкреонекроза обусловлено контаминацией условно-патогенной микрофлорой эндогенного (толстокишечного) и экзогенного (у оперированого больного по дренажам и тампонам из окружения палаты интенсивной терапии) происхождения.
Первые сообщения об остром панкреатите
1641 – Голландский врач van Tulp N. (Тульпиус) первым наблюдал абсцесс ПЖ при аутопсии.
1578 – Alberti S. – Самое первое описание секционного наблюдения острого воспаления поджелудочной железы.
1673 – Greisel первым описал клинический случай некроза поджелудочной железы , приведшего к смерти через 18 часов после начала заболевания и подтвержденного при аутопсии.
1694 – Diemenbroek I. наблюдал патологоанатомическую семиотику панкреонекроза у купца из Лейдена, страдавшего гнойным панкреатитом .
1762 – Stoerk описал клиническую картину «геморрагии в поджелудочную железу.
1804 – Portal описал наблюдения некроза и абсцесса поджелудочной железы.
1813 – Периваль наблюдал случай большого абсцесса поджелудочной жезазы.
1830 – Рекур продемонстрировал врачебному обществу препарат поджелудочной железы с множественными абсцессами.
1831 – Lawrence опубликовал наблюдение геморрагического панкреатита.
1842 – Claessen первым клинически распознал острый панкреатит
1842 – Карл Рокитанский изучил патологоанатомическую картину воспалительных заболеваний поджелудочной железы
1864 – Ancelet издал в Париже первое руководство по заболеваниям поджелудочной железы.
1865 – Карл Рокитанский подробно изучил патологическую анатомию геморрагического панкреатита.
1866 – Шписс описал случай смерти от «обширного кровоизлияния» в ПЖ.
1867 – Luke и Klebs первыми осуществили первую чрескожную пункцию ложной кисты поджелудочной железы , но больной вскоре умер.
1870 – Klebs — американский патологоанатом разработал самую первую классификацию острого панкреатита, оказавшуюся настолько удачной, что в работах его многочисленных последователей она подвергалась лишь разнообразным уточнениям.
1874 – Zenker описал « апоплексию» поджелудочной железы .
1881 – Tirsh и Kulenkampf предложили наружное дренирование постнекротических кист.
1882 – Американский хирург Bozeman успешно удалил панкреатическую кисту, симулировавшую большую кисту яичника.
1882 – Balser провел морфологические исследования жирового некроза при остром панкреатите.
1882 – Gussenbauer установил диагноз ложной кисты поджелудочной железы и произвел одномоментную цистостомию (марсупиализацию) ввиду невозможности ее иссечения ввиду близости ее к крупным сосудам.
1886 – Miculicz предложил выполнять марсупиализацию при панкреонекрозе и абсцессе поджелудочной железы.
1886 – Американский хирург Senn предложил оперативное лечение, т.к. был убежден, что хирургическое вмешательство положительно повлияет на исход заболевания при некрозе или абсцессе поджелудочной железы.
1889 – Reginald Fitz – патологоанатом Массачусетского Госпиталя в США предложил первую классификацию, включавшую пять форм острого панкреатита. Пропагандировал экстренное хирургическое вмешательство, в котором вскоре разочаровался, заявив, что «ранняя операция неэффективна и опасна».
1890 – Вышло в свет первое руководство по хирургическому лечению заболеваний поджелудочной железы ( Braun ).
1894 – Проблема острого панкреатита впервые обсуждалась на съезде хирургов Германии, на котором Керте предложил тактику неотложного хирургического вмешательства.
1895 – Издана первая монография посвященная патологической анатомии заболеваний поджелудочной железы ( Diekhoff ).
1896 – Австрийский патолог Chiari H . выдвинул гипотезу о значении «самопереваривания» в развитии некроза поджелудочной железы и парапанкреальной жировой клетчатки.
1897 – Русский хирург Мартынов А.В. защитил первую в России диссертацию, посвященную заболеваниям поджелудочной железы. Характеризуя трудность диагностики острого панкреатита, он писал: « При распознавании острого панкреатита «ошибка является правилом, тогда как правильный диагноз – исключением». Современный ему этап изучения заболеваний поджелудочной железы А.В.Мартынов называл «периодом знакомства с клинической стороной патологии».
1897 – Hale-White Н.Н. опубликовал отчет прозектуры Guy’s Hospital в Лондоне, включавший 142 наблюдения различных заболеваний поджелудочной железы и, практически, все варианты патологических изменений паренхимы и протоков этого органа.
1899 – Разумовский показал, что, несмотря на то, что летальный исход представляет обычный конец панкреатических геморрагий, в «известных случаях возможно и выздоровление».
1900 – Bessel-Hagen предложил дренирование кист поджелудочной железы путем цистогастростомии .
1901 – Opie E . L . и Halsted W . S . указали на этиопатогенетическую связь между холелитиазом и геморрагическим панкреатитом, сформулировав «теорию общего канала ».
Дата добавления: 2015-04-30; просмотров: 1632; Опубликованный материал нарушает авторские права? | Защита персональных данных | ЗАКАЗАТЬ РАБОТУ
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Только сон приблежает студента к концу лекции. А чужой храп его отдаляет. 8769 — | 7497 — или читать все…
Читайте также:
Источник

