Механизмы развития хронического панкреатита
Одним из ведущих механизмов развития хронического воспалительного процесса в поджелудочной железе является задержка выделения и внутриорганная активация панкреатических ферментов, в первую очередь трипсина и липазы, осуществляющих постепенно аутолиз паренхимы железы. Одновременно происходит реактивное разрастание соединительной ткани, которая затем рубцово сморщивается, приводя к склерозированию органа. В развитии, и особенно прогрессировании хронического воспалительного процесса, большое значение имеют процессы аутоагрессии.
При хронических панкреатитах инфекционного происхождения возбудитель может проникнуть в поджелудочную железу из просвета двенадцатиперстной кишки или из желчных путей через панкреатические протоки восходящим путем, чему способствует дискинезия пищеварительного тракта, сопровождающаяся дуоде-нопанкреатическим или холедохопанкреатнчееким рефлюксом.
Предрасполагают к возникновению хроническою панкреатита препятствия для выделения панкреатического сока в двенадцатиперстную кишку (спазм, воспалительный стеноз, опухоль печеночно-поджелудочной ампулы и др.), а также недостаточность сфинктера печеночно-поджелудочной ампулы (сфинктера Одди), облегчающая попадание дуоденального содержимого, активирующего трипсин, в проток поджелудочной железы (вирсунгов проток).
Действие перечисленных этиологических факторов имеет следствием нарушение панкреатического сокоотделения и активацию протеолитических ферментов поджелудочной железы внутри ее протоков.
У некоторых больных хронический панкреатит возникает как исход острого.
Под влиянием вышеуказанных этиологических факторов развивается дистрофия, а затем атрофия слизистой оболочки двенадцатиперстной кишки, снижение ее регенераторной способности. Это вызывает нарушение продукции в ней секретина и холецистокинина — панкреозимина. Вследствие дефицита секретина повышается давление в двенадцатиперстной кишке, спазмируется сфинктер Одди, увеличивается давление в панкреатическом протоке, уменьшается объем панкреатического сока за счет снижения объема жидкой части и бикарбонатов.
В результате этого происходит сгущение панкреатического сока, снижается скорость его оттока, повышается концентрация в нем белка, что ведет к преципитации белка, образованию различных пробок, закупоривающих различные отделы панкреатических протоков. Под влиянием алкоголя, пищевых погрешностей панкреатический секрет выходит в окружающую межуточную ткань с образованием отека поджелудочной железы. В этих условиях активизируются ферменты панкреатического сока, происходит самопереваривание железы.
С другой стороны, в результате сдавления в условиях отека ткани поджелудочной железы атрофируются ацинозные железы с заменой их соединительной тканью.
В патогенезе хронического панкреатита имеют значение также активация хининовой системы, свертывающей системы, нарушение микроциркуляции, распространение инфекции из желчных путей, затекание желчи в панкреатический проток при нарушении функции большого дуоденального соска. Следует учитывать и иммунологический механизм.
peд. Ю.Eлиceeвa
Заболевания поджелудочной железы, подробнее…
Дополнительная информация из раздела
- Хронический панкреатит
- Симптомы хронического панкреатита
- Вся информация по этому вопросу
Источник
Хронический панкреатит — это воспалительное заболевание поджелудочной железы, сопровождающееся необратимым разрушением ее экзокринной части, фиброзом и разрушением эндокринной части поджелудочной железы на поздней стадии заболевания.
Хронический панкреатит может проявляться повторяющимися приступами острого панкреатита, но основным отличием хронического панкреатита является необратимое нарушение функции поджелудочной железы. Частота хронического панкреатита варьирует от 0,04 до 5%. Причины острого и хронического панкреатита практически идентичны, но самой частой причиной хронического панкреатита является длительное злоупотребление алкоголем. Заболевание чаще наблюдают у мужчин среднего возраста.
Реже хронический панкреатит вызывают:
— длительная обструкция протока поджелудочной железы, обусловленная псевдокистой, камнями, опухолями, травмой или разделенной поджелудочной железой. При этом часто отмечают расширение панкреатического протока;
— тропический панкреатит. Заболевание наблюдается у жителей Африки и Азии и практически не описано. В некоторых случаях причиной являются наследственные нарушения;
— наследственный панкреатит, развитие которого связано с зародышевой мутацией гена PRSS1 или SPINK1. Может быть как острым, так и хроническим;
— мутация гена CFTR. Развитие кистозного фиброза связано с наличием двухаллельной наследственной мутации гена CFTR. Мутации этого гена уменьшают секрецию бикарбонатов клетками протоков поджелудочной железы, что способствует образованию белковых пробок и развитию хронического панкреатита. Мутации гена CFTR выявляют у 25-30% пациентов с идиопатическим панкреатитом, т.е. в 5 раз чаще, чем в общей популяции.
У 40% пациентов с хроническим панкреатитом не удается выявить предрасполагающие факторы, однако, как и при остром панкреатите, все большее число таких «идиопатических» случаев связано с наследственными мутациями панкреатит-ассоциированных генов.
а) Патогенез. Патогенез хронического панкреатита до конца не ясен. Практически у всех лиц с повторяющимися приступами острого панкреатита в дальнейшем развивается хронический панкреатит. Это позволяет предположить, что острый панкреатит запускает процесс перилобулярного фиброза и деформации протока, а также нарушает процесс секреции панкреатического сока. Со временем, после многократных приступов, это может привести к утрате паренхимы поджелудочной железы и фиброзу. Предположительно в развитие хронического панкреатита вносят свой вклад следующие факторы:
1. Обструкция протоков камнями и белковыми пробками. Считают, что некоторые факторы, приводящие к развитию хронического панкреатита, способны повышать концентрацию белка в панкреатическом соке. В результате образуются белковые пробки в просвете протоков. Такие пробки особенно быстро формируются при алкогольном хроническом панкреатите. Белковые пробки могут обызвествляться и формировать камни из осажденного карбоната кальция, которые также закрывают просвет протоков и способствуют прогрессированию хронического панкреатита.
2. Токсины. Токсины, включая алкоголь и его метаболиты, могут оказывать прямое повреждающее действие на ацинарные клетки.
3. Окислительный стресс. Вызванный алкоголем окислительный стресс может приводить к образованию в ацинарных клетках свободных радикалов, усиливающих окисление липидов мембран и активирующих факторы транскрипции, включая АР-1 и NF-кВ, которые, в свою очередь, стимулируют экспрессию хемокинов, рекрутирующих мононуклеарные клетки. Окислительный стресс может индуцировать слияние лизосом и зимогенных гранул, некроз ацинарных клеток, воспаление и фиброз.
При хроническом панкреатите обнаружено большое количество хемокинов, включая IL-8 и моноцитарный хемоаттрактантный белок. Кроме того, TGF-b и PDGF вызывают активацию и пролиферацию периацинарных миофибробластов (звездчатых клеток поджелудочной железы), что приводит к отложению коллагена и в конечном итоге к фиброзу. Хемокины, вырабатываемые при хроническом панкреатите, сходны с таковыми при остром панкреатите, однако профиброгенные хемокины вырабатываются преимущественно при хроническом панкреатите.
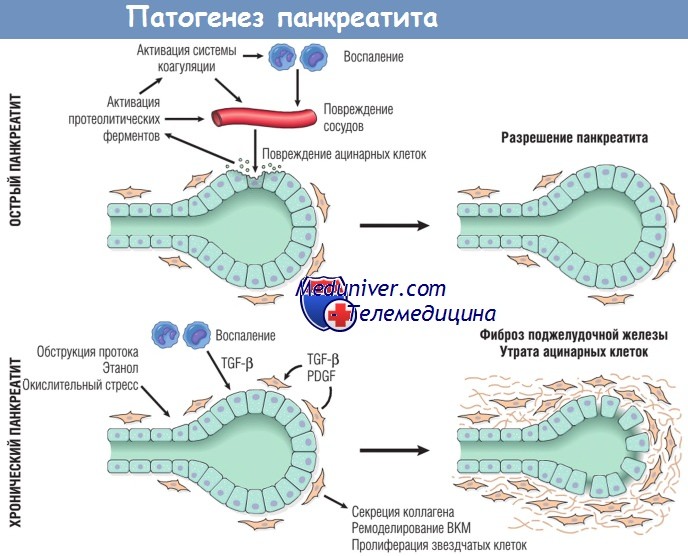
Особенности взаимодействий медиаторов при остром и хроническом панкреатите.
При остром панкреатите повреждение ацинарных клеток приводит к высвобождению протеолитических ферментов,
запускающих каскад реакций, запускающих активацию системы коагуляции, острое и хроническое воспаление, повреждение сосудов и отек.
У большинства пациентов после острого повреждения происходит восстановление ацинарных клеток.
При хроническом панкреатите повторяющиеся эпизоды повреждения ацинарных клеток приводят к выработке фиброгенных цитокинов,
таких как трансформирующий фактор роста р (TGF-p) и тромбоцитарный фактор роста (PDGF), что вызывает пролиферацию звездчатых клеток,
выработку коллагена и ремоделирование внеклеточного матрикса (ВКМ).
В итоге это приводит к необратимой утрате ацинарных клеток, фиброзу и недостаточности поджелудочной железы.
б) Морфология. Хронический панкреатит характеризуется фиброзом паренхимы, уменьшением количества и размеров ацинусов с относительно сохранными островками Лангерганса, а также различной степенью расширения панкреатических протоков. Эти изменения обычно сопровождаются хронической воспалительной инфильтрацией вокруг долек и протоков. Междольковые и внутридольковые протоки часто расширены и содержат в своем просвете белковые пробки.
Протоковый эпителий может быть атрофичным или гиперплазированным, иногда онподвергается плоскоклеточной метаплазии, в просвете протоков могут определяться конкременты. Характерным признаком хронического панкреатита является исчезновение ацинусов. Сохранные островки Лангерганса окружены фиброзной тканью, могут сливаться и увеличиваться, но в конечном итоге они тоже исчезают. Макроскопически железа плотная, местами с резко расширенными протоками и видимыми кальцификатами.
Лимфоплазмоцитарный склерозирующий панкреатит (аутоиммунный панкреатит) — особая форма хронического панкреатита, характеризующаяся наличием перипротоковой смешанно-клеточной воспалительной инфильтрации, венулитов и увеличением количества IgG4-продуцирующих плазматических клеток [40]. Лимфоплазмоцитарный склерозирующий панкреатит очень важно отличать от клинически схожего рака поджелудочной железы. Лимфоплазмоцитарный склерозирующий панкреатит хорошо поддается лечению кортикостероидами.
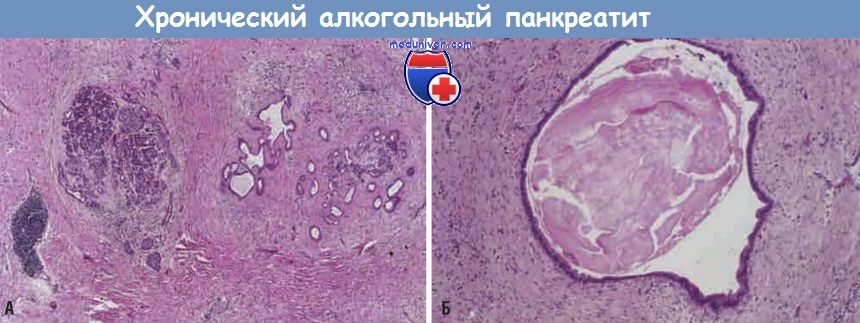
Хронический алкогольный панкреатит:
(А) При малом увеличении видны выраженный фиброз и атрофия с наличием остаточных островков {слева) и протоков (справа) с рассеянными клетками хронического воспаления и ацинарной тканью.
(Б) При большом увеличении виден расширенный проток с густым эозинофильным содержимым.
в) Клинические признаки. Хронический панкреатит имеет разнообразные клинические формы. Он может проявляться повторяющимися приступами боли умеренной интенсивности в области живота, повторяющимися приступами легкой боли или постоянной болью в области живота и спины. Заболевание может протекать бессимптомно до тех пор, пока не разовьются недостаточность поджелудочной железы и сахарный диабет, связанный с разрушением островков Лангерганса.
В ряде случаев на заболевание поджелудочной железы могут указать повторяющиеся эпизоды желтухи и расстройства пищеварения. Приступы могут быть спровоцированы злоупотреблением алкоголем, перееданием (которые увеличивают нагрузку на поджелудочную железу), а также использованием опиатов или других лекарственных средств, повышающих тонус сфинктера Одди.
При диагностике хронического панкреатита клиницист должен быть особенно внимательным. Во время приступов боли в животе могут отмечаться умеренная лихорадка и незначительное или умеренное повышение уровня амилазы в сыворотке крови. Однако при длительном течении заболевания разрушение ацинарных клеток может препятствовать появлению этого диагностического признака. Обструкцию, обусловленную желчными камнями, можно выявить по наличию желтухи и повышенному уровню щелочной фосфатазы в сыворотке крови.
Очень помогают в диагностике обнаружение кальцификатов в ткани поджелудочной железы с помощью компьютерной томографии или ультразвукового исследования, а также снижение массы тела и гипопротеинемические отеки вследствие нарушения всасывания (мальабсорбции), вызванного недостаточностью поджелудочной железы.
Хронический панкреатит обычно неопасное для жизни состояние, однако прогноз для лиц с длительно текущим заболеванием неблагоприятный. Смертность в течение 20-25 лет достигает 50%. Могут развиться тяжелая недостаточность экзокринной функции поджелудочной железы и синдром хронической мальабсорбции, а также сахарный диабет.
Основная проблема у некоторых пациентов — выраженный хронический болевой синдром. У 10% пациентов формируются псевдокисты поджелудочной железы. У лиц с наследственным панкреатитом риск развития рака поджелудочной железы составляет 40%, но риск малигнизации при других формах хронического панкреатита неизвестен.
Компьютерная томография: срез при кальцинозном панкреатите, поражающем головку железы
— Рекомендуем ознакомиться со следующей статьей «Механизм развития (патогенез) кисты поджелудочной железы»
Оглавление темы «Патогенез болезней ЖКТ»:
- Механизм развития (патогенез) атрезии желчных протоков
- Механизм развития (патогенез) кисты холедоха
- Механизм развития (патогенез) рака желчного пузыря
- Строение и функции поджелудочной железы
- Механизм развития (патогенез) пороков развития поджелудочной железы
- Механизм развития (патогенез) острого панкреатита
- Механизм развития (патогенез) хронического панкреатита
- Механизм развития (патогенез) кисты поджелудочной железы
- Механизм развития (патогенез) кистозных опухолей поджелудочной железы
- Механизм развития (патогенез) рака поджелудочной железы
Источник
В большинстве рассмотренных выше теорий важнейшая роль отведена нарушениям в системе перекисного окисления липидов, иммунным и микроциркуляторным изменениям, неспецифическим для всех форм панкреатитов. Действительно, если рассматривать ХП как хронический воспалительный процесс, то он должен сопровождаться нарушением деятельности основополагающих гомеостатических систем организма. Говоря о ХП, следует в первую очередь упомянуть систему микроциркуляции, антиоксидантную и иммунную систему, включая функционирование цитокиновой сети.
Кальцификация и панкреатолитиаз
Панкреатолитиаз и кальцификацию паренхимы ПЖ наблюдают практически при всех этиологических вариантах развития ХП, за исключением аутоиммунного ХП. Необходимо различать панкреатолитиаз (образование конкрементов протоков) и кальцификацию (calcificatio pancreatica). В последнем случае катьцификаты локализованы непосредственно в ткани ПЖ. Чаще кальцификация сочетается с панкреатолитиазом, реже эти состояния изолированы. При наличии конкрементов в протоках принято говорить об обструктивном ХП, обусловленном панкреатолитиазом, при катьцификатах паренхимы ПЖ — о кальцифицирующем панкреатите.
До настоящего времени не вполне доказана однородность группы панкреатитов, протекающих с панкреатолитиазом и кальпификацией. Н. Sarles в 1991 г высказано предположение о существовании двух разновидностей заболевания, сопровождающегося образованием камней в ПЖ. Первая разновидность характеризуется наличием камней правильной формы с высокой степенью кальцификации и имеет чёткую связь с употреблением ачкоголя или недостаточным (неполноценным) питанием.
Для второй разновидности характерно наличие мелких нерастворимых протеиновых пробок со слабой степенью кальцификации. Такие микролиты чаще всего рентгенонегативиы. Их образование не связывают со злоупотреблением алкоголем и неполноценным питанием, считают врождённым. Открытия последних лет, в частности расшифровка патогенеза НП, выделение в отдельную форму тропического панкреатита и анализ морфологических и клинических особенностей заболевания, не укладываются в более ранние представления Н. Sarles.
Патогенез этих форм панкреатитов различен, но их многие механизмы тесно переплетаются.
Кальцификация. Кальцифицирующий ХП обычно возникает вследствие очагового панкреонекроза с отложением кальция в местах предшествующего некроза. Это происходит вследствие того, что под действием липазы в очагах жирового некроза нейтральный жир расщепляется до жирных кислот и глицерина, а затем кальций секрета ПЖ образует нерастворимые соли жирных кислот, которые и осаждаются в месте некроза.
Второй возможный механизм кальцификации предложен в рамках изложенной выше теории малых протоков Н. Sarles (теория интрадуктального литиаза), когда преципитация белка во внутридольковых или вставочных протоках приводит к их обструкции и прогрессирующему фиброзу ацинуса. Как известно, в условиях обструкции значительно облегчается выпадение солей кальция, которые в результате локализуются в зонах фиброза, отдельно от протоковой системы ПЖ.
После открытия литостатина стали считать, что именно этот белок в условиях блока мелких протоков, связываясь с кристаллами кальция, приводит к кальцификации. Однако данные о том, что протеиновые бляшки (пробки) преимущественно состоят из десквамированного эпителия (а не из протеинов), а в центре образовавшихся панкреатических камней часто отсутствует кальций, отчасти опровергают эту теорию.
Панкреатолитиаз. Механизм камнеобразования до сих пор полностью не ясен. Основные положения теории развития панкреатолитиаза сводятся к трём моментам: гиперсекреции кальция и лактоферрина, функциональной роли литостатина. Действительно, несмотря на прогрессирующее уменьшение экзокринной секреции бикарбонатов и ферментов ПЖ при ХП, обнаруживают увеличение секреции кальция и лактоферрина.
Гиперсекреция кальция
При ХП повышена базальная секреция кальция, его секреция в ответ на перфузию кишечника изотоническим раствором хлорида натрия и внутривенное введение холецистокинина. Повышение секреции кальция у больных с ХП не зависит от его концентрации в сыворотке крови, этиологии панкреатита, предшествующей холецистэктомии и наличия или отсутствия рентгенологически определяемых кальцификатов. В то же время при раке ПЖ секреция кальция снижена.
Следовательно, её увеличение — не общий симптом различных заболеваний поджелудочной железы, а признак, характерный лишь для ХП. Интересен тот факт, что количество кальция и белка в панкреатическом секрете увеличивается уже на ранней стадии хронического алкогольного панкреатита (до образования кальцификатов).
Повышенное содержание кальция в секрете ПЖ способствует ускорению активации трипсиногена, а его соли могут осаждаться в щелочной среде, физиологической для панкреатических протоков. Активация трипсиногена внутри железы в сочетании с обструкцией её протоков кальциево-белковыми микропреципитатами, образующимися на ранних стадиях экспериментального алкогольного панкреатита у собак, позволяет объяснить механизм развития кальцифицирующего ХП (в частности, связанного с алкоголизмом). Неизвестно, предшествует ли избыточная экзокринная секреция кальция заболеванию.
Лактоферрин
В противовес литостатиновой теории было предположено, что если причина формирования белковых пробок — преципитация белка, зависящая от его концентрации в панкреатическом соке, то можно определить высокое содержание некоторых протеинов. Так, при анализе панкреатического сока у больных с ХП была обнаружена большая концентрация железо-связывающего белка — лактоферрин, Было высказано предположение, что лактоферрин может играть роль в формировании белковых пробок, что связано с его способностью потенцировать агрегацию крупных ацидофильных белков (например, альбумина).
Существует мнение, что повышение содержания лактоферрина в панкреатическом соке характерно только для больных с панкреатолитиазом, поскольку при других заболеваниях ПЖ не обнаруживают высокую концентрацию лактоферрина в панкреатическом соке. Считают, что секреция лактоферрина не коррелирует ни с потреблением алкоголя, ни с экзокринной недостаточностью ПЖ, также как до сих пор неизвестно, предшествует ли болезни повышение его концентрации в панкреатическом соке или это её следствие.
Литостатин, трипсин и другие белки панкреатического сока
Широкий диапазон содержания в конкрементах литостатина (0,01-85% общего количества белка) наводит на мысль, что механизмы камнеобразования могут быть многофакторными, а белковые компоненты конкрементов — весьма разнообразными. Другими словами, литостатин — далеко не единственный белок, вовлечённый в формирование конкрементов. Интересно, что при отсутствии литостатина в конкрементах в них отмечают высокое содержание лактоферрина.
Инфекционные факторы
В панкреатических конкрементах были обнаружены жизнеспособные бактерии, возможно, влияющие на развитие калькулёза протоковой системы. В других исследованиях у больных с ХП была определена антибактериальная активность панкреатического сока, что предполагает наличие эндогенного защитного антибактериального механизма и косвенно подтверждает возможность участия инфекционных агентов в камнеобразовании.
Изменения протокового эпителия
У больных с панкреатолитиазом отмечены качественные и количественные изменения продукции гликопротеинов дуктулоцитами. Усиленный синтез нейтральных гликопротеинов, утрата способности секретировать сиалогликопротеины приводит к изменению физико-химических свойств слизи — увеличению вязкости, нестойкости буферных систем слизи и, в результате, к метаболическому обызвествлению с образованием камней в протоках. Кроме того, подобные изменения вызывают снижение протективных свойств слизи. Эта концепция, безусловно, интересна, но всё же не ясно, насколько первичны обнаруженные изменения в отношении внутртипротокового образования конкрементов.
Нарушения в системе перекисного окисления липидов и синтез оксида азота
Модификация атьбумина и его спонтанный гидролиз в панкреатическом соке происходит при добавлении в него продуктов перекисного окисления липидов (ПОЛ). Это даёт основания говорить об индуцирующей (промотирующей) роли ПОЛ и его продуктов в спонтанном гидролизе панкреатических белков (включая литостатин и образование нерастворимых протеиново-кальциевых преципитатов).
Прямое влияние свободных радикалов кислорода на динамику морфологических изменений в ПЖ in vivo изучено в единичных экспериментальных исследованиях. В одной из недавних публикаций были представлены результаты изучения эффектов пероксида водорода на изменение проходимости ГПП и динамику морфологических изменений ПЖ у кошек. Интрадуктальное введение пероксида водорода вызывало ОП с типичными гистологическими изменениями в паренхиме ПЖ. В то же время при внутривенном введении Н202 не отмечено достоверных гистологических изменений ПЖ.
Существуют данные, что при неосложнённом течении ХП антиоксидантная система сбалансирована, в то время как при развитии кист, кальцификации ПЖ и псевдотуморозных формах ХП обнаруживают дисбаланс антиоксидантной системы, зависящий от тяжести и длительности заболевания. Нормализацию состояния ПОЛ у пациентов с болевой формой ХП не наблюдают даже после достижения ремиссии. У больных с неосложнённым ХП и рецидивирующим ОП отмечены существенно более низкие плазменные концентрации селена, витамина А, Е, Р-каротина, ксантина, в-криптоксантина и ликопена по сравнению со здоровыми лицами.
Таким образом, о сбалансированности антиоксидантной системы даже при неосложнённом течении ХП говорить не приходится. Кроме того, определено, что нет существенных различий между профилями антиоксидантов у больных с алкогольным ХП, идиопатическим ХП и рецидивирующим ОП. Это наблюдение подчёркивает общность этого патогенетического механизма дтя всех форм панкреатитов.
Интенсификация ПОЛ при ХП поддерживает локальный воспалительный процесс, способствует нарушению микроциркуляции и обменных процессов в ПЖ, угнетению тканевого дыхания, что, в свою очередь, приводит к дегенерации ткани органа.
Оксид азота (N0) — двухатомная свободнорадикальная молекула, отсутствие заряда и малые размеры которой обеспечивают липофильность и высокую способность к проникновению через мембраны клеток и клеточных структур.
Среднее время жизни в биологических тканях — 5,6 с. Наличие одного электрона с неспаренным спином придаёт молекуле NO высокую реакционную способность и увеличивает спектр биологического действия. Обнаружено цитотоксическое действие N0. Существуют данные, что при синтезе оксида азота в условиях воспаления, это соединение индуцирует вазодилатацию, локальное поражение паренхимы органа, подверженного воспалению, и его ишемию. Эффекты, вызываемые NO, играют важную роль в механизмах развития ОП и ХП.
Нарушения микроциркуляции и гемостаза
Нарушения микроциркуляции в ПЖ сопровождают большинство этиологических форм панкреатитов и служат одним из патогенетических звеньев ХП. Их считают ведущими при ишемическом панкреатите и панкреатитах, возникающих на фоне системных заболеваний соединительной ткани и васкулитов. Патогенетическое значение нарушений микроциркуляции вряд ли оспоримо, поскольку нарушения терминального кровообращения в ПЖ отрицательно сказываются на состоянии её экзокринной и эндокринной функции.
По данным допплерометрии, у больных с ХП отмечены нарушения кровотока, наиболее выраженные в головке ПЖ. Обострение ХП характеризуется пре- и постпрандиальной недостаточностью спланхнического кровотока. По данным морфологического исследования резецированных участков ПЖ установлено, что наиболее распространённые изменения внутриорганных артериальных стволов ПЖ — гипертрофия мышечного слоя, гиперэластоз, дистонические изменения артерий среднего и малого калибра. Эти изменения наблюдают в 30% случаев, что позволяет сделать вывод о существенных, возможно первичных нарушениях кровоснабжения ПЖ при обострении ХП.
В период обострения ХП повышается свёртывающая активность крови и одновременно снижается фибринолитическая активность. Увеличивается агрегация тромбоцитов, нарушаются реологические свойства крови, её вязкость, изменяются физико-химические свойства эритроцитов.
Иммунные нарушения
В настоящее время существует значительное количество научных работ, демонстрирующих значительные нарушения в клеточном и гуморальном звене иммунитета при ХП. В большинстве исследований клеточного иммунитета при ХП отмечено снижение содержания Т-лимфоцитов. При переходе в ремиссию количество Т-лимфоцитов возрастает, но остаётся достоверно сниженным. При обострении ХП уменьшается количество Т-хелперов и Т-супрессоров, а также изменяется соотношение между ними. Некоторые авторы на основании соотношения хелперы/супрессоры выделяют группы больных ХП с аутоиммунным компонентом (хелперы/супрессоры < 1,5) и с иммунодефицитом (хелперы/супрессоры >5,0).
Наиболее изучены клеточные иммунологические реакции к ткани ПЖ при ХП. Более чем у половины больных ХП отмечают положительную реакцию бластформации лимфоцитов на ткань ПЖ. Не существует единою мнения относительно выраженности клеточных иммунологических реакций к ткани ПЖ в стадии обострения и ремиссии. Ряд исследователей отмечают их усиление в стадии обострения, в то время как существуют данные об их повышении в стадии ремиссии ХП.
Есть мнение, что клеточные иммунологические реакции к ткани ПЖ обнаруживают у больных с ХП с одинаковой частотой (и в стадии ремиссии, и в стадии обострения заболевания). У больных с ХП отмечена положительная реакция торможения миграции лейкоцитов с антигеном из ткани ПЖ; обнаружена клеточная сенсибилизация к трипсину и инсулину с наибольшими изменениями в период обострения. Таким образом, вполне обоснованным выглядит мнение о ведущей роли клеточного звена иммунитета в хронизации и прогрессировании ХП, в то время как при ОП, преимущественно отмечают изменения гуморального иммунитета.
Литературные данные о содержании в крови основных классов иммуноглобулинов при ХП крайне разноречивы и, вероятно, их изолированное определение не имеет самостоятельного диагностического значения. Важное звено воспаления — активация компонентов системы комплемента, способных демонстрировать хемотаксическую активность, вызывать лизис клеток, участвовать в развёртывании иммунологических реакций. При обострении ХП отмечено снижение комплементарной активности, что можно объяснить наличием противопанкреатических антител и участием их в иммунных реакциях с потреблением комплемента. Снижение активности компонентов системы комплемента сохраняется и в стадии ремиссии ХП. Этот эффект объясняют образованием иммунных комплексов с антителами к трипсину, инсулину и антигену из тканей ПЖ.
Местный иммунитет при ХП изучен недостаточно. Это связано с трудностями биопсии органа и протеолизом иммуноглобулинов ферментами в полученном для исследования панкреатическом секрете. Результаты определения концентрации иммуноглобулинов в панкреатическом соке также неоднозначны, как и при их определении в крови. С одной стороны, есть указания на практически полное отсутствие в панкреатическом соке секреторного IgA. С другой стороны, учитывая существенное его повышение при обострении ХП, предлагают использование этого показателя в качестве диагностического критерия.
Существуют данные, что среди больных с ХП обнаруживают существенные изменения в частоте распределения антигенов системы HLA по сравнению со здоровыми людьми, что, вероятно, обусловливает степень выраженности гуморальных иммунных реакций.
Цитокины
Провоспалительные и регуляторные цитокины играют ключевую роль в патогенезе острого и хронического панкреатита. Известна важная роль цитокинов в формировании фиброза ПЖ, панкреонекроза, а при поступлении их в общий кровоток (при трансформации местной воспалительной реакции в системную) — в развитии синдрома интоксикации и полиорганной недостаточности (частая причина смерти при ОП).
Даже при умеренном панкреатите, индуцированном ЭРХПГ, происходит значительный системный выброс цитокинов. В настоящее время доказано, что дисбалане про- и противовоспалительных цитокинов в пользу первых потенцирует воспалительный процесс (в том числе и при панкреатитах). Нарушение продукции цитокинов может служить одним из звеньев патогенеза ХП в связи с потенцированием фиброгенеза некоторыми из них.
Апоптоз
Существенное значение в патогенезе панкреатитов играет апоптоз ацинарных клеток, замыкающий патогенетическую цепь и ускоряющий процессы фиброгенеза в ПЖ. Апоптоз — генетически запрограммированная гибель клеток живого организма, сопровождаемая характерными цитологическими признаками и молекулярно-генетической перестройкой.
Его вызывают различные повреждающие факторы: вирусные, токсические (в том числе, липополисахарид грамотрицательных бактерий), лекарственные, нарушения кровоснабжения и др. Эффектами апоптоза может быть оксидативный стресс, активация протеаз, дисрегуляция обмена кальция. Отсюда понятно, что при чрезмерном усилении апоптоза (при ОП важную роль в этом играет бактериальный липополисахарид) развивается некроз, т.е. усугубляется аутолиз ПЖ. При ослаблении апоптоза усиливается пролиферация генетически повреждённых клеток, что приводит к гиперплазии и опухолевой трансформации.
Регулирует апоптоз ген р53, а ингибируют гены bс12, c-fos, c-myc. При длительном воспалении (особенно вирусном) происходят мутации этих генов: р53 начинает ингибировать апоптоз, а bс12 усиливает своё влияние через эпидермальный, тромбоцитарный, а- и в-трансформирующие факторы роста. В результате извращается регенерация, усиленно пролиферируют генетические изменённые клетки, удлиняется продолжительность жизни клеток и увеличивается вероятность возникновения в них изменений. Всё это способствует преднеопластической, а затем и неопластической пролиферации.
Маев И.В., Кучерявый Ю.А.
Опубликовал Константин Моканов
Источник


