Антиоксидантная терапия острого панкреатита
Комментарии
Опубликовано в журнале:
« Хирургия » № 3, 2005
Профессора Н.А. Кузнецов и Г.В. Родоман, кандидаты мед. наук А.Т. Бронтвейн и Л.А. Лаберко, Н.В. Мальгина, И.Р. Сумеди
Российский государственный медицинский университет, городская клиническая больница №13, клиническая больница №1 Медицинского центра Управления делами Президента РФ, Москва
Работа основана на результатах обследования и лечения 103 больных панкреонекрозом, находившихся в клинике обшей хирургии на базе ГКБ №13 с 1997 по 2003 г. Исследовано влияние антиоксиданта мексидола на течение острого панкреатита (ОП). Установлено, что мексидол при ОП позволяет замедлить течение деструктивных процессов в поджелудочной железе, способствует быстрому отграничению воспалительного процесса, нормализует клинико-лабораторную картину заболевания, что в итоге позволяет существенно уменьшить частоту развития тяжелых осложнений ОП и снизить летальность.
Results of application of synthetic antioxidants in treatment of patients with destructive pancreatitis
N.A. Kuznetsov, G.V. Rodoman, A.T. Brontvein, L.A. Laberko, N.V. Malgina, I.R. Sumedi
Results of examination and treatment of 103 patients with pancreonecrosis are presented. Influence of antioxidant mexidol on acute pancreatitis (AP) was studied. It is demonstrated that mexidol in AP permits to slow down destructive processes in the pancreas, promotes localization of inflammation and normalization of clinical and laboratory picture of the disease that permits to decrease significantly number of severe complications of AP and reduce lethality.
Khirurgiia (Mosk) 2005; 3: 36-39
Острый панкреатит (ОП) является одной из наиболее актуальных проблем ургентной хирургии. Повсеместно отмечается рост заболеваемости острым панкреатитом и увеличение числа деструктивных форм заболевания [5]. Среди острых хирургических заболеваний органов брюшной полости ОП занимает третье место после острого холецистита и острого аппендицита и составляет 12% [3]. При явном прогрессе хирургических технологий результаты лечения панкреонекроза все же не могут считаться удовлетворительными, поскольку до настоящего времени летальность остается высокой, а сроки лечения — длительными. При стерильном панкреонекрозе летальность достигает 50%, при гнойном панкреонекрозе с явлениями панкреатогенного сепсиса — 80%. Социальная значимость проблемы обусловлена еще и тем, что 70% больных — лица трудоспособного возраста [6, 7].
Патогенез заболевания довольно сложен. Согласно существующим в настоящее время представлениям, острый панкреатит — это первично асептическое воспаление демаркационного типа, характеризующееся каскадной активацией ферментов поджелудочной железы и их аутоагрессией [8]. Морфологические исследования показали, что интегральным моментом, предопределяющим последующее развитие патофизиологических и биохимических нарушений в поджелудочной железе (ПЖ) и организме в целом, при ОП являются функциональные, а затем и структурные изменения клеточных мембран [9]. Поджелудочная железа очень чувствительна к недостатку кислорода и избытку углекислого газа в крови. При ОП наблюдаются значительные изменения кровообращения в сосудах бассейна чревного ствола и верхней брыжеечной артерии, что во многом определяет течение патологического процесса в ПЖ и его генерализацию. Многими исследователями признано участие липопероксидации в развитии патологических процессов в ПЖ. Антиоксидантная активность ПЖ слабая и при ОП создаются все условия для резкой активации липопероксидации [4].
Показано, что применение антиоксидантов при остром панкреатите обеспечивает защиту мембранных структур, препятствует прогрессированию морфофункциональных клеточных нарушений, снижает тяжесть эндогенной интоксикации и выраженность системных нарушений липидного обмена [1]. Одним из препаратов, обладающих антиоксидантными свойствами, является мексидол (2-этил-6-метил-3-оксипиридина сукцинат) — ингибитор свободнорадикальных процессов перекисного окисления липидов, активирующий супероксиддисмутазу и оказывающий влияние на физико-химические свойства клеточной мембраны. Механизм действия мексидола определяется прежде всего его способностью стабилизировать биологические мембраны клеток, активировать энергосинтезирующие функции митохондрий, модулировать работу рецепторных комплексов и прохождение ионных токов, усиливать связывание эндогенных веществ. Мексидол повышает резистентность организма к воздействию экстремальных факторов и кислородзависимым патологическим состояниям [2].
Материал и методы
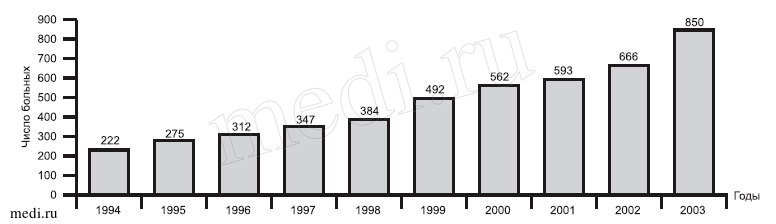
Тенденцию к увеличению числа больных с острым панкреатитом подтверждает статистика их госпитализации в хирургические отделения общего профиля ГКБ №13 Москвы (см. рисунок).
Рис. Рост числа больных с острым панкреатитом, находившихся на лечении в ГКБ №13.
Работа основана на результатах обследования и лечения 103 больных панкреонекрозом в период с 1997 по 2003 г. Мексидол в комплексе лечебных мероприятий был применен у 51 больного (основная группа), 52 пациента составили контрольную группу, в которой этот препарат не использовали. Основная и контрольная группы больных сопоставимы по полу, возрасту, времени, прошедшему с момента заболевания, форме панкреонекроза. Ведущим этиологическим фактором заболевания в обеих группах был алиментарный — соответственно 26 и 34%, билиарный фактор составил соответственно 74 и 66%, причем доминирующее место среди причин острого панкреатита занимал прием алкоголя.
Все больные в условиях хирургического и реанимационного отделений получали комплексное лечение, базисными компонентами которого являлись инфузионная терапия, внутривенное введение соматостатина или его аналогов, антиферментная, антисекреторная, кардиотоническая и антибактериальная терапия. При постановке диагноза панкреонекроза и его осложнений использовалась классификация, рекомендованная на IX Всероссийском съезде хирургов (2000 г.).
Стандартная схема обследования больных включала клиническую оценку их состояния, общий и биохимический анализы крови, определение уровня средне-молекулярных соединений плазмы крови и мочи, лапароскопическое и ультразвуковое исследование органов брюшной полости. Об уровне энзимной токсемии судили по показателям α-амилазы крови и α-амилазы мочи. Масштаб и характер поражения поджелудочной железы, забрюшинной клетчатки и органов брюшной полости оценивали на основании расчета индекса поражения брюшной полости (ИПБП) [5]. Необходимую дозу мексидола подбирали после оценки тяжести состояния пациента в соответствии со шкалой тяжести физиологического состояния (ТФС) [5]. В зависимости от величины суммарного балла ТФС в обеих группах было выделено по 4 подгруппы больных.
Первая подгруппа — ТФС 1-3 балла. Такие значения ТФС имели 13 пациентов основной группы (получали мексидол) и 13 пациентов контрольной группы (мексидол не получали). Летальных исходов не было. У больных этой подгруппы преобладали очаговое поражение поджелудочной железы и жировая форма ацинарной деструкции. Мексидол вводили по 100-200 мг 3 раза в сутки внутривенно и внутримышечно в течение 5 дней.
Вторая подгруппа — ТФС 4-7 баллов. Такие значения ТФС имели 15 пациентов основной группы и 15 пациентов контрольной группы. Различные формы ацинарной деструкции и масштабы поражения поджелудочной железы встречались одинаково часто. В этой подгруппе больным основной группы мексидол вводили по 200 мг 3 раза в сутки в течение 7-10 дней.
Третья подгруппа — ТФС 8-11 баллов. Такие значения ТФС имели 12 пациентов основной группы и 12 пациентов контрольной группы. Доминировали наблюдения смешанной и геморрагической ацинарной деструкции поджелудочной железы с преобладанием субтотально-тотальных форм некротического панкреатита. У больных этой подгруппы острый некротический панкреатит протекал в тяжелой форме, с явлениями панкреатогенного шока, распространенного панкреатогенного перитонита и гнойных парапанкреатических осложнений. Стартовую терапию мексидолом проводили с учетом тяжести состояния больных, манифестации панкреатогенного шока. При наличии последнего в первые сутки лечения суточная доза составляла 1000 мг за два приема. После стабилизации состояния больного мексидол вводили по 300 мг 3 раза в сутки в течение 8-10 дней с постепенным уменьшением дозы.
Четвертая подгруппа — ТФС 12 и более баллов. Такие значения ТФС имели 11 пациентов основной группы и 12 пациентов контрольной группы. Больные четвертой подгруппы характеризовались наиболее тяжелым течением заболевания с преобладанием геморрагической формы ацинарной деструкции и тотальным поражением поджелудочной железы. У всех наблюдалось развитие панкреатогенного шока и распространенного панкреатогенного перитонита, на следующей стадии заболевания развивались гнойные осложнения с прогрессированием эндогенной интоксикации и манифестацией синдрома полиорганной недостаточности. В этой подгруппе схема лечения мексидолом больных основной группы была следующей: стартовая доза 1000 мг в сутки до стойкого купирования явлений панкреатогенного шока в среднем до 5 дней, в дальнейшем по 300-400 мг 3 раза в сутки в течение 10-14 дней с постепенным снижением дозы.
Статистическую обработку полученных результатов проводили с использованием критериев Стьюдента.
Результаты и обсуждение
Первая подгруппа больных. У больных с наименьшей степенью тяжести состояния применение мексидола в комплексе лечения привело к более быстрому купированию явлений ферментемии, эндогенной интоксикации и улучшению субъективного состояния. Клиническая и лабораторная реконвалесценция наступала в среднем к 5-м суткам лечения (табл. 1).
Таблииа 1. Динамика лабораторных показателей у больных первой подгруппы
| Показатель | Основная группа | Контрольная группа | ||
| 1-е сутки | 5-е сутки | 1-е сутки | 5-е сутки | |
| МСМ плазмы, ед . опт. пл. | 0,49±0,04 | 0,24±0,02* | 0,56±0,08 | 0,48±0,07 |
| МСМ мочи, ед. опт . пл. | 1,09±0,19 | 0,35±0,06* | 1,19±0,33 | 0,79±0,11 |
| Лейкоциты, *109/л | 13,05±1,31 | 7,15±0,57* | 10,24±0,78 | 10,39±1,24 |
| α-амилаза мочи, ед/л | 11007±2553 | 434±72* | 2535±852 | 640±154* |
| АлАТ (аланинаминотрансфераза), ед/л | 156,3±34,7 | 60,2±18,9* | 204,9±40,4 | 148,4±26,5 |
| Альбумин, г/л | 39,2±2,8 | 53,1±2,7* | 42,7±3,1 | 35,8±2,7 |
Примечание. Здесь и в табл. 2 и 3: * — различия достоверны (p<0,05). МСМ — молекулы средней массы.
В первой подгруппе у больных основной группы (получавших мексидол) к 5-м суткам лечения количество лейкоцитов достоверно снизилось в 1,8 раза, уровень МСМ плазмы — в 2 раза, МСМ мочи — в 3 раза, содержание α-амилазы мочи — в 13,3 раза, АлАТ — в 2,6 раза и концентрация сывороточного альбумина увеличилась в 1,3 раза. В этой погруппе у больных, не получавших мексидола (контрольная группа), достоверного изменения показателей лейкоцитов, МСМ и АлАТ не произошло, содержание α-амилазы мочи достоверно уменьшилось в 3,9 раза, содержание альбумина снизилось в 1,2 раза по сравнению с исходным уровнем. Применение мексидола не только улучшило динамику лабораторных показателей у больных первой подгруппы, но и оказало влияние на течение процесса в поджелудочной железе и брюшной полости, о чем свидетельствует достоверное снижение ИПБП в 4,5 раза. У больных первой подгруппы, не получавших мексидола, к 5-м суткам лечения динамика ИПБП отсутствовала. Осложненное течение острого панкреатита в первой подгруппе у получавших мексидол больных наблюдалось в 1,6 раза реже, чем у больных, в лечении которых мексидол не применялся (p<0,05).
Таким образом, анализ результатов лечения в этой подгруппе показал, что применение мексидола позволило добиться более быстрой нормализации общего состояния больных, лабораторных показателей и снизить вероятность осложнений, за счет чего произошло достоверное сокращение среднего срока пребывания в стационаре в 1,3 раза.
Вторая подгруппа больных. Клиническая и лабораторная реконвалесценция в этой подгруппе у получавших мексидол больных наступила в среднем к 7-м суткам лечения (табл. 2).
Таблица 2. Динамика лабораторных показателей у больных второй подгруппы
| Показатель | Основная группа | Контрольная группа | ||
| 1-е сутки | 7-е сутки | 1-е сутки | 7-е сутки | |
| МСМ плазмы, ед . опт. пл. | 0,46±0,04 | 0,26±0,02* | 0,63±0,1 | 0,53±0,1 |
| МСМ мочи, ед. опт . пл. | 1,05±0,16 | 0,33±0,04* | 0,96±0,22 | 0,75±0,161 |
| Сахар, ммоль/л | 6,49±0,69 | 4,8±0,25* | 7,23±0,91 | 6,51±0,7 |
| α-амилаза мочи, ед/л | 7464±4021 | 436±179 | 4986±823 | 515±179* |
| Альбумин, г/л | 38,6±0,5 | 47,5±0,6* | 41,1±0,5 | 29,6±0,6* |
В этой подгруппе у больных, леченных без мексидола, к 7-м суткам отсутствовало достоверное снижение уровней СМ и сахара крови, наблюдалось прогрессивное снижение содержания альбумина. Напротив, на фоне лечения мексидолом произошло достоверное снижение уровня МСМ плазмы в 1,8 раза, МСМ мочи в 3,2 раза, сахара крови в 1,4 раза, содержание сывороточного альбумина увеличилось в 1,2 раза. Отмечена также положительная динамика состояния поджелудочной железы: ИПБП на фоне применения мексидола достоверно снизился в 2 раза (p<0,05). У больных, леченных без мексидола, изменения ИПБП к 7-м суткам отсутствовали. Частота осложнений у получавших мексидол больных была в 6,7 раза ниже, чем без его применения (p<0,05).
Таким образом, анализ результатов лечения больных этой подгруппы показал, что применение мексидола позволило добиться более быстрой нормализации лабораторных показателей и значительно снизить вероятность осложнении, за счет чего произошло достоверное сокращение среднего срока пребывания в стационаре в 1,9 раза.
Третья подгруппа больных. Клиническая и лабораторная реконвалесценция в этой подгруппе у получавших мексидол больных наступала в среднем к 10-м суткам лечения (табл. 3).
Таблица 3. Динамика лабораторных показателей у больных третьей подгруппы
| Показатель | Основная группа | Контрольная группа | ||
| 1-е сутки | 10-е сутки | 1-е сутки | 10-е сутки | |
| МСМ плазмы, ед . опт. пл. | 0,93±0,19 | 0,41±0,08* | 1,13±0,29 | 0,89±0,14 |
| α-амилаза мочи, ед/л | 2307±671 | 350±89* | 856±171 | 473±88 |
| Альбумин, г/л | 36,4±2,9 | 48,1±3,4* | 36,0±2,8 | 27,1±2* |
Без применения мексидола к 10-м суткам лечения отсутствовало достоверное снижение содержания МСМ и амилазы мочи и наблюдалось прогрессивное снижение уровня альбумина, при лечении мексидолом произошло достоверное снижение уровня МСМ плазмы в 1,6 раза и α-амилазы мочи в 6,6 раза, а также повышение содержания альбумина в 1,3 раза. Кроме того, на фоне применения мексидола в третьей подгруппе отмечена тенденция к снижению количества лейкоцитов, содержания трансаминаз, билирубина и мочевины.
Достоверные изменения ИПБП отсутствовали, однако на фоне применения мексидола частота осложнений достоверно снизилась в 6,7 раза (p<0,05). В третьей подгруппе летальных исходов в группе больных, получавших мексидол, не было, в группе не получавших этого препарата они составили 8,3%.
При лечении мексидолом отмечено снижение продолжительности лечения в стационаре в 1,4 раза (p<0,05). Таким образом, применение мексидола в этой подгруппе больных привело к значительным положительным результатам.
Четвертая подгруппа больных. Отмечен выраженный противошоковый эффект мексидола с отчетливой стабилизацией основных физиологических параметров, характеризующих состояние больных. Это позволило в 3 наблюдениях выполнить необходимые оперативные вмешательства, в 2 — повторные. Частота гнойных осложнений снизилась в 1,3 раза. На фоне применения мексидола отмечено снижение летальности как на стадии панкреатогенного шока, так и на стадии гнойных осложнений панкреонекроза. В четвертой подгруппе летальный исход при использовании мексидола имел место в 55% наблюдений, без его применения — в 100%, т.е. данный показатель снизился в 1,8 раза.
Представленные данные свидетельствуют об отчетливом благоприятном влиянии мексидола на динамику местного патологического процесса не только в ткани поджелудочной железы, но и в парапанкреатической зоне и в брюшной полости с прогрессивным снижением величины ИПБП. Препарат позволяет эффективно снижать уровень ферментемии, тяжесть проявлений эндогенной интоксикации, оказывает выраженное неспецифическое противовоспалительное, антигипоксантное, гепатопротекторное действие. Очевидна благоприятная тенденция динамики клинико-лабораторных показателей заболевания у больных, получавших мексидол. Все основные показатели приобретали отчетливую тенденцию к нормализации в более ранние сроки, чем у больных контрольной группы, что является критерием стабилизации и купирования воспалительно-некротических процессов, восстановления функционального состояния поджелудочной железы и печени, коррекции нарушений гомеостаза.
Таким образом, использование ингибиторов перекисного окисления липидов позволяет замедлить деструктивные процессы в поджелудочной железе, способствует более быстрому отграничению воспалительных изменений, нормализации клинико-лабораторных показателей и снижению риска летального исхода при некротическом панкреатите.
ЛИТЕРАТУРА
- Власов А.П., Подеров В.Н., Саушев И.В. и др. Нарушения и коррекция гомеостаза при панкреонекрозе. Материалы IX Всероссийского съезда хирургов. Волгоград 2000; 20-22.
- Воронина Т.А. Информационные материалы НИИ фармакологии РАМН. 1999; 1-2: 2-6.
- Ермолов А.С., Иванов П.А., Гришин А.В. и др. Современное состояние диагностики и лечения острого панкреатита. Всероссийский съезд хирургов, 9-й: Материалы. Волгоград 2000; 45-46.
- Колесова О.Е., Маркин А.А., Федорова Т.Н. Перекисное окисление липидов и методы определения продуктов липопероксидации в биологических средах. Лаб дело 1984; 9: 540-546.
- Нестеренко Ю.А., Лаптев В.В., Михайлусов С.В. и др. Лечение панкреонекроза. Рос мед журн 2002; 1: 3-10.
- Савельев B.C., Филимонов М.И., Бурневич С.З. и др. Деструктивный панкреатит: комплексная диагностика и лечение. Новый мед журн 1997; 3: 10-13.
- Савельев B.C., Филимонов М.И., Гельфанд Б.Р. и др. Оценка эффективности современных методов лечения деструктивного панкреатита. Анналы хиргепатол 1996; 1: 58-61.
- Савельев B.C., Гельфанд Б.Р., Филимонов М.Й и др. Оптимизация лечения панкреонекроза: роль активной хирургической тактики и антибактериальной терапии. Анналы хир 2000; 2: 12-16.
- Филимонов М.И., Гельфанд Б.Р., Бурневич С.З. и др. Острый панкреатит 2000; 7-8: 13-14.
Поступила 20.04.04
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Роль и место антиоксидантной терапии в лечении острого деструктивного панкреатита
В отличие от острого интерстициального панкреатита, острый деструктивный панкреатит (ОДП) имеет фазовое течение:
- Ферментативная фаза (первые 5 суток ОП);
- Реактивная (вторая неделя заболевания);
- Фаза секвестрации некротических очагов (начиная с 3 недели) [1].
Длительно существовавшая теория аутолиза поджелудочной железы и ферментной токсемии не об’ясняла в полной мере как пусковые механизмы развития панкреонекроза, так и тяжесть состояния больных. В настоящее время считается, что уже в раннем периоде, наряду с ферментной токсемией, развивается синдром системной воспалительной реакции (ССВР) [2,3]. Именно этот синд-ром ответствен за дальнейшее прогрессирующее повреждение паренхимы ПЖ, её некроз и развитие полиорганной недостаточности (ПОН) [4,5,6]. ССВР придается большое значение не только при остром панкреатите, но и в целом ряде критических клинических состояний как инфекционной, так и неинфекционной природы [7,8]. С синдромом системной воспалительной реакции тесно связаны процессы перекисного окисления липидов (ПОЛ) [9,10], так как кислород-галогеновые радикалы служат обязательными важными участниками воспаления и их экзоцитоз свойствен любому акту фагоцитоза. В условиях воспаления и ишемии нарушается баланс перекисных реакций, запускается анаэробный путь гликолиза, растёт количество недоокисленных метаболитов, значительно увеличивается концентрация свободных радикалов кислорода. Поскольку поджелудочная железа имеет самый низкий уровень содержания антиоксидантов, антиоксидантные системы быстро истощаются, что приводит к развитию окислительного стресса [11]. В ответ на окислительный стресс активизируется глютатионовый окислительно-восстановительный цикл, маркером эффективности которого является восстановленный глютатион. При недостаточности антиоксидантной защиты (АОЗ) происходит пероксидация мембранных липи-дов, что ведет к повреждению ацинарных клеток [12].
Несмотря на большое число работ, посвященных свободнорадикальному окислению при ОП, в литературе до сих пор нет окончательного представления о роли свободнорадикальных форм кислорода и состоянии антиоксидантной защиты на разных стадиях ОДП, нет четкого представления о месте антиоксидантной терапии.
Целью настоящего исследования явилось динамическое исследование этих процессов на всех этапах развития ОДП для определения сроков проведения антиоксидантной терапии.
Материалы и методы исследования. Основу работы составляют результаты клинических исследований, проведенных у 98 больных острым деструктивным панкреатитом (ОДП). Пациентов в возрасте до 60 лет было 61 (62,2%), старше 60 лет — 37 (37,8%). Мужчин было – 69 (70,4%), женщин – 29 (29,6%). Диагноз ОДП подтвержден данными ультразвукового исследования (УЗИ), компьютерной томографии (КТ), лапароскопии (ЛС), результатами обследования во время операции, лабораторными данными.
Состояние ПОЛ и АОЗ обследовано у 76 больных в ферментативной фазе, в реактивной – у 38, в фазе секвестрации – у 18 человек.
Из 98 больных ОДП оперативному лечению в ферментативной фазе подвергнуто 56 пациентов, на стадии секвестрации – 8. Показаниями к оперативному лечению на ранней стадии ОДП служили: разлитой перитонит, нарастающая эндогенная интоксикация при наличии выпота в брюшной полости и (или) сальниковой сумке, прогрессирующая желтуха, деструктивные изменения со стороны желчного пузыря. На поздней стадии показаниями к операции были гнойные осложнения.
Оценка тяжести ОП проводилась по системе прогнозирования тяжести ОП [13].
Состояние перекисного окисления липидов оценивали по концентрации малонового диальдегида (МДА) по методу M.Uchiyama в модификации С.И.Глушкова. Антиоксидантную защиту — по уровню восстановленного глутатиона (ВГ) по методике G.L.Ellman в модификации С.И.Глушкова.
Всем больным были выполнены инструментальные методы исследования для определения жидкостных коллекторов в серозных полостях, забрюшинной клетчатке и в поджелудочной железе. УЗИ проводились на аппарате «Aloka SSD – 260» в режиме реального времени с помощью секторального датчика с частотой излучения 3,5 МГц. Компьютерная томография (КТ) выполнялась на аппарате Toshiba Aguilion 16, магнитно-резонансная томография (МРТ) на аппарате General Electric 1 Tesla.
Статистическая обработка выполнена в оболочке программных средств Excel 5.0 и Statistika for Windows IBM – совместимого компьютера. Сравнение совокупностей проводилось на уровне значимости р ‹ 0,05.
Результаты. ПОЛ и АОЗ в ферментативной фазе ОДП. Из 76 больных ОДП, обследованных в этом периоде, легкий панкреа-тит диагностирован у 27 пациентов, средней тяжести — у 23 и тяже-лый- у 26 пациентов. В группе больных с легким панкреатитом мужчин было 23, женщин 4. Средний возраст составил 45,9±2,8 лет. В группе больных средней тяжести мужчин было 17, женщин 6, средний возраст составил 44,8±3 лет. В группе больных тяжелым панкреатитом мужчин было 17, женщин 9. Средний возраст в этой группе составил 44 ±2,9 лет. Состояние перекисного окисления липидов в группах больных ОДП в ферментативной фазе представлено в табл.1.
При исследовании динамики МДА у больных в зависимости от степени тяжести острого панкреатита было выявлено, что уже в 1-е сутки заболевания, когда интенсивность перекисных процессов уве-личивается в 2,5 – 3 раза по сравнению с нормальными значениями, прослеживается корреляция уровня МДА с тяжестью ОП. Разница значений статистически достоверна в группах сравнений «легкий – средней тяжести и тяжелый», а в группах «средней тяжести – тяжелый» — только тенденция к увеличению МДА при тяжелом ОП (p›0,05).
Таблица 1.
Показатели МДА в ферментативной фазе ОДП в зависимости от
степени тяжести острого панкреатита
Контроль (МДА нмоль/мл) | Степень тяжести ОПОП | Больные ОП (МДА нмоль/мл) Периоды наблюдений (сутки от начала ОП) | ||
1 | 3 | 5 | ||
5,6 ± 0,4 | Легкий | 12,7 ± 0,4* | 15,5 ± 0,3** | 14,2 ± 0,6* |
Ср. тяжести | 14,8 ± 0,7* | 17,9 ± 0,6** | 16,7 ± 0,5* | |
Тяжелый | 15,5 ± 0,5* | 19,3 ± 0,5** | 18,1 ± 0,4* | |
Примечание: *- достоверность отличий с контрольной группой.
**- достоверность отличий с предыдущим периодом исследования.
К 3-м суткам заболевания (пик ферментативной фазы) во всех группах наблюдались максимальные значения МДА. В этом периоде наибольший показатель зарегистрирован в группе больных с тяжелым панкреатитом — 19,3±0,5 нмоль/мл, что в 3,4 раза больше показателя контрольной группы (р‹0,05). В разгаре ферментативной фазы прослеживается четкая корреляция в уровне малонового диальдегида с тяжестью ОП. Различия во всех сравниваемых группах статистически достоверны (р‹0,05).
Таблица 2.
Показатели восстановленного глютатиона в группах больных с легким,
средней тяжести и тяжелым острым панкреатитом
Контроль (ВГммоль/л) | Степень тяжести ОП | Больные ОП (ВГ ммоль/л) Периоды наблюдений (сутки от начала ОП) | ||
1 | 3 | 5 | ||
0,82±0,02 | Легкий | 0,43±0,01* | 0,36±0,01*** | 0,37±0,03* |
Средней тяжести | 0,41±0,01* | 0,32±0,02*** | 0,31±0,01* | |
Тяжелый | 0,39*±0,02* | 0,28±0,02*** | 0,27±0,01* | |
Примечание: *- достоверность отличий с контрольной группой.
**- достоверность отличий с предыдущим периодом исследования.
К концу ферментативной фазы, к 5-м суткам от начала забо-левания наблюдалась только тенденция к снижению данного пока-зателя во всех группах с сохранением четкой корреляционной зависимости МДА с тяжестью ОП. Разница в значениях МДА во всех сравниваемых группах статистически достоверна (р‹0,05). При оценке состояния антиоксидантной защиты во всех сравниваемых группах наблюдалось угнетение АОЗ, что выражалось в значительном снижении восстановленного глутатиона по сравнению с нормальными значениями. Разница показателей ВГ в 1-е сутки от начала заболевания была статистически достоверной только в группах «легкий – тяжелый ОП»). К 3-м суткам она была недостоверной только в группах «средней тяжести- тяжелый» (p›0,05). К концу ферментативной фазы — к 5-м суткам от начала заболевания, тяжесть ОП коррелировала с низкими значениями ВГ (табл.2).
Динамика состояния антиоксидантной защиты в зависимости от степени тяжести ОП представлена в табл. 2.
Характеристика перекисного окисления липидов и анти-оксидантной защиты в реактивной фазе ОДП. В реактивной фазе ОДП обследовано 38 больных. Мужчин было 23 (60,5%), женщин 15 (39,5%). Преобладали лица в возрасте до 60 лет (79%). Средний возраст в этой группе составлял 37,2±6,8 лет. В группе старше 60 лет — 67,6± 3,1 лет. В общую группу вошли пациенты, которые в ферментативной фазе трактовались как больные с ОП средней тяжести – 20 и тяжелым – 18. Биохимические исследования проводили на 7, 10 и 15 сутки от момента развития ОДП, охватывая всю реактивную фазу ОДП. Динамика МДА в реактивной фазе ОДП представлена в табл. 3.
Из табл.3 видно, что к 7 суткам ОДП малоновый диальдегид был на цифрах 10,1±1,3 нмоль/мл, что значительно выше по отноше-нию к контролю и достоверно ниже по сравнению с предыдущим периодом исследования в ферментативной фазе – 5 сутки (табл.1). К 10 суткам от момента развития ОДП ситуация принципиально не изменялась по отношению к 7 суткам. Значения МДА во втором периоде наблюдений были на цифрах 10,5±0,9 нмоль/мл (р›0,05), и приближались к нормальным значениям только к 15 суткам, то есть к концу реактивной фазы.
Таблица 3.
Показатели МДА у больных ОДП в реактивной фазе
Контроль (МДА нмоль/мл) | Больные с ОП (МДА нмоль/мл) Периоды наблюдений (сутки от начала ОП) | ||
7 | 10 | 15 | |
5,6±0,4 | 10,1±1,3* | 10,5±0,9* | 7,9±0,5*** |
Примечание: *- достоверность отличий с контрольной группой.
**- достоверность отличий с предыдущим периодом исследования.
Состояние АОЗ по динамике восстановленного глютатиона пред-ставлено в табл. 4.
Таблица 4.
Динамика восстановленного глютатиона в реактивной фазе ОДП
Контроль (ВГ ммоль/л) | Больные с ОП (ВГ ммоль/л) Периоды наблюдений (сутки от начала ОП) | ||
7 | 10 | 15 | |
0,82±0,02 | 0,45±0,025* | 0,53±0,07* | 0,58±0,03* |
Примечание: *- достоверность отличий с контрольной группой.
Показатели восстановленного глютатиона, по сравнению с предыдущим периодом (табл.2), несколько увеличивались к 7 суткам заболевания – начальному периоду реактивной фазы (0,450,025 мкмоль/ мл). Значения этого показателя сохранялись практически на том же уровне к 10 и 15 суткам, соответственно: 0,53±0,07 и 0,58±0,03 мкмоль/мл, разница значений статистически недостоверна (р>0,05). И оставались ниже контрольных значений на протяжении всей реактивной фазы (табл.5).
Характеристика ПОЛ и АОЗ на стадии секвестрации. Исследования проводились в общей группе больных ОДП из 18 человек, которые в ферментативной фазе трактовались как больные с ОП средней тяжести и тяжелым, и все они были прооперированы в раннем периоде лапароскопически. У 11 из них стадия секвестрации протекала в асептических условиях, а 7 человек были оперированы в этом периоде в связи с развитием гнойных осложнений — некр- и секвестрэктомии с дренированием гнойных полостей. Исследования проводились за 1 сутки до операции или непосредственно перед опе-рацией, в среднем на 17-20 сутки от момента развития ОДП.
Состояние ПОЛ и АОЗ в двух анализируемых группах больных на стадии секвестрации представлены в табл.5.
Обсуждение. Проведенные исследования показали, что в ферментативной фазе ОДП наблюдается резкое повышение перекис-ного окисления липидов, достигающее максимальных значений к 3 суткам от начала заболевания с постепенным последующим снижением их интенсивности. Выраженная активация ПОЛ, протекающая на фоне снижения антиоксидантной защиты в этом периоде, позволяет признать ферментативную фазу ОДП как яркую модель окислительного стресса. Глубина и выраженность нарушений в данной системе коррелирует со степенью тяжести ОП, что определяет важную роль свободнорадикальных форм кислорода в патогенезе развития деструктивных форм острого панкреатита и требует интенсивной антиоксидантной терапии в этом периоде.
Таблица 5.
Состояние ПОЛ и АОЗ по данным малонового диальдегида и
восстановленного глютатиона на стадии секвестрации
(17-20 сутки ОДП)
Контроль | ОДП без гнойных осложнений | ОДП с гнойными осложнениями |
МДА нмоль/мл | МДА нмоль/мл | МДА нмоль/мл |
5,6±0,4 | 7,4±0,5 | 11,8±1,2*** |
ВГ ммоль/л | ВГ ммоль/л | ВГ ммоль/л |
0,82±0,02 | 0,52±0,03* | 0,44±0,05* |
Примечание: * — достоверность отличий по отношению к контролю,
** — к группе больных с асептическим течением фазы секвестрации.
Приближение показателей перекисного окисления липидов к нормальным значениям при асептическом течении ОДП наблюдается только к 15 суткам (концу реактивной фазы). На стадии секвестрации, протекающей в септических условиях наблюдается вторая волна повышения перекисного окисления липидов, что в совокупности с другими клинико-лабораторными данными может указывать на развитие гнойных осложнений.
Показатели антиоксидантной защиты остаются сниженными на протяжении всего периода ОДП вплоть до выписки больных из стационара.
В указанных периодах повышения перекисного окисления липидов антиоксидантная терапия наиболее актуальна.
Литература
- Филин В.И. О фазах развития и клинических формах острого панкреатита // Вестн. хир. 1982. №6. С. 20-24.
- Ревтович М. Ю. Вариант неспецифической антицитокиновой терапии деструктивных форм острого панкреатита // Белорусский медицинский журнал. 2003. № 3. С. 94 – 97.
- Papachristou GI, Papachristou DJ, Avula H. Obesity increases the severity of acute pancreatitis: performance of APACHE-O score and correlation with the inflammatory response // Pancreatology. 2006. № 6(4). Р. 279 – 285.
- Yasuda T., Ueda T., Takeyama Y. Significant increase of serum high-mobility group box chromosomal protein 1 levels in patients with severe acute pancreatitis // Pancreas. 2006. № 33(4). Р. 359 – 363.
- Толстой А. Д., Багненко С. Ф., Красногоров В. Б. Острый панкреатит: протоколы диагностики и лечения // Хирургия. 2005. № 7. С. 19 – 23.
- Raraty M.G., Connor S., Criddle D.N., Sutton R., Neoptolemos J.P. Acute pancreatitis and organ failure: pathophysiology, natural history and management strategies // Curr Gastroenterol Rep. 2004 .v.6, N2. P.99-103.
- Гусев Е.Ю., Черешнев В.А., Юрченко Л.Н. Системное воспаление с позиции теории типового патологического процесса //Цитокины и воспаление. 2007.Т.6, №4.С.9-11.
- Кубышкин А.В., Фомочкина И.И. Патогенетическая взаимосвязь синдрома системной воспалительной реакции и шока //Вестник Санкт-Петербургского университета. 2011. Сер.11, Вып.3. С.69 — 75.
- Леонович С. И., Ревтович М. Ю., Чумаков В. Н. Влияние октреотида на перекисное окисление липидов у больных острым пакреатитом // Рецепт. 2003. № 3. С. 112 – 115.
- Granger J., Remick D. Acute pancreatitis: models, markers, and mediators // Shock. 2005. № 24(1). Р. 45–51.
- Миронов А. С. Этиология и патогенез острого панкреатита // Хирургия. 2004. №8. С.72 – 75.
- Кузнецов Н. А., Родоман Г. В., Бронтвейн А. Г. Результаты применения синтетических антиоксидантов в лечении больных деструктивным панкреатитом // Хирургия. 2005. № 3. С. 36 – 39.
- Багненко С. Ф., Толстой А. Д. Острый панкреатит. Протоколы диагностики и лечения // Анналы хирургической гепатологии. 2006. Т. 11. № 1. С. 60 – 66.
Источник