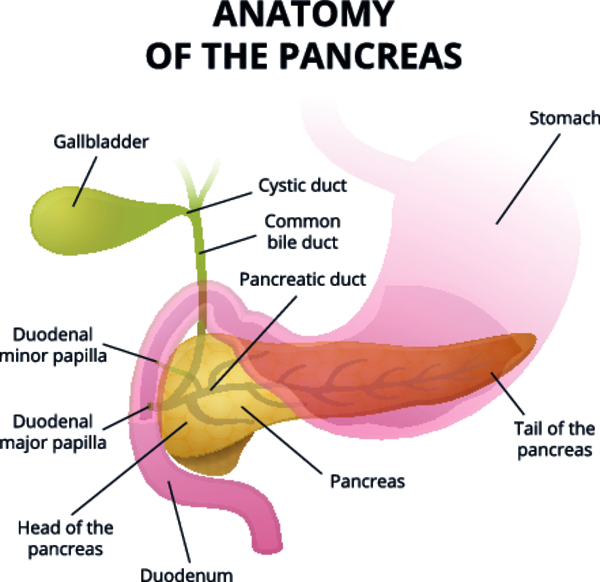
Тактика ведения больных с панкреатитом
Острый панкреатит заболевание, имеющее несколько степеней тяжести от лёгкой, с тенденцией к самовыздоровлению, при которой необходима непродолжительная госпитализация, до быстропрогрессирующей, злокачественной формы, сопровождающейся полиорганной недостаточностью (ПОН) и сепсисом. Тяжёлые формы панкреатита, требующие госпитализации в отделении реанимации и интенсивной терапии (ОРИТ) встречаются у небольшого числа пациентов, однако летальность у этой категории больных достигает 30-50%, а средняя продолжительность госпитализации составляет более 1 месяца.
В 2004 г. состоялась международная согласительная конференция, в которой приняли участие представители Американского торакального общества (ATS), Европейского респираторного общества (ERS), Европейского общества интенсивной терапии (ESICM), Общества критической медицины (SCCM) и Французского реаниматологического общества (SRLF). Целью конференции явилась разработка рекомендаций по лечению пациентов с тяжёлым острым панкреатитом (ТОП), находящихся в критическом состоянии и госпитализированных в ОРИТ. Новые рекомендации, в отличие от предложенных ранее, составлены на основании доказательных данных. В согласовании рекомендаций приняли участие 10 экспертов специалистов в области хирургии, терапии и медицины критических состояний. Всего было предложено 23 рекомендации, затрагивающие основные аспекты лечения пациентов с ТОП:
- Когда надо госпитализировать пациентов в ОРИТ для мониторинга параметров жизнедеятельности?
- Должны ли антибиотики назначаться для профилактики инфекционных осложнений всем пациентам с ТОП?
- Каким должен быть режим и время начала нутритивной поддержки?
- Каковы показания для хирургического вмешательства при остром панкреатите, оптимальное время для вмешательства и каково значение менее инвазивных хирургических процедур, как, например, чрескожное дренирование и лапароскопия?
- Каковы показания для хирургического удаления камней из желчных путей у пациентов с билиарным панкреатитом?
- Существуют ли доказательные данные для назначения противовоспалительной терапии?
В ходе обсуждения были разработаны рекомендации по ведению данной категории пациентов:
I. Когда надо госпитализировать пациентов в ОРИТ для мониторинга параметров жизнедеятельности?
Одним из факторов риска отрицательного исхода у пациентов с тяжёлым острым панкреатитом является раннее развитие органной недостаточности. Наличие нескольких систем оценки тяжести состояния у больных панкреатитом, биологических маркеров и рентгенологических признаков тяжести процесса для раннего выявления пациентов из группы риска по развитию полиорганной недостаточности подразумевают динамическое наблюдение в условиях ОРИТ. Основой ведения также является раннее начало инфузионной терапии, которую наиболее целесообразно проводить в ОРИТ.
Рекомендация 1. Не существует специфических критериев для госпитализации в ОРИТ пациентов с тяжёлым острым панкреатитом. Следует ориентироваться на традиционные, общепринятые показания для госпитализации. Особое внимание необходимо уделять пациентам с высоким риском быстрой отрицательной динамики: пожилые, с избытком массы тела (>30 кг/м2), требующие непрерывного проведения инфузионной терапии и пациенты с большим объёмом панкреонекроза (>30%). Уровень доказательности 5, категория D.
Рекомендация 2. По возможности, пациентов с тяжёлым острым панкреатитом должен наблюдать многопрофильный коллектив врачей под руководством реаниматолога. Необходимо обеспечить доступ к проведению дополнительных методов исследования: эндоскопии, эндоскопической ретроградной холангиопакреатографии (ЭРХПГ), обычной операционной, а также кабинету для проведения вмешательств под радиологическим контролем. Уровень доказательности 3а, категория В.
Рекомендация 3. Следует проводить инвазивный мониторинг гемодинамики. Необходимо проводить ежедневную оценку состояния (клиническое обследование, диурез, газы крови) с оценкой функции лёгких (гипоксемия). Специфичные шкалы необходимо использовать для выявления пациентов из групп риска по развитию осложнений, однако, это не должно заменять динамическое наблюдение больного. Уровень доказательности 5, категория D.
Рекомендация 4. Вместо определения уровня маркеров, таких как, например, С-реактивный белок и прокальцитонин, рекомендуется руководствоваться общими данными клинического состояния для уточнения динамики тяжёлого острого панкреатита и для сортировки больных. Уровень доказательности 5, категория D.
Рекомендация 5. При затруднении в диагностике при первом осмотре, для подтверждения диагноза и дифференциальной диагностики, при отсутствии противопоказаний, рекомендована компьютерная томография органов ЖКТ (с в/в контрастированием) после проведения адекватной инфузионной терапии. Уровень доказательности 5, категория D.
Рекомендация 6. Для выявления местных осложнений, проведение компьютерной томографии, по возможности, рекомендуется отложить на 48-72 ч ввиду того, что панкреонекроз может не визуализироваться раньше этого срока. Уровень доказательности 5, категория D.
II. Должны ли антибиотики назначаться с профилактической целью пациентам с ТОП?
Инфекционные осложнения с панкреонекрозом развиваются у 30-50% пациентов, что подтверждается данными исследований с помощью компьютерной томографии или непосредственно во время проведения оперативного вмешательства. Эти пациенты также подвержены более высокому риску развития полиорганной недостаточности и летального исхода.
Рекомендация 7. Ввиду низкого уровния доказательств, полученных в результате нескольких клинических исследований и данных мета-анализов, профилактическое использование системных антибактериальных и противогрибковых препаратов у пациентов с панкреонекрозом не рекомендовано. Уровень доказательности 2b, категория В.
Рекомендация 8. Селективная деконтаминация кишечника не рекомендована у пациентов с панкреонекрозом. Для подтверждения данной стратегии ведения пациентов с тяжёлым острым панкреатитом необходимы дальнейшие исследования.
III. Каким должен быть режим и время начала нутритивной поддержки?
Состояние пациентов с тяжёлым острым панкреатитом часто характеризуется как усиленный метаболизм, поэтому своевременное назначение нутритивной поддержки необходимо для профилактики мальабсорбции.
Рекомендация 9. У пациентов с тяжёлым острым панкреатитом предпочтительно назначение энтерального питания перед парентеральным. Энтеральное питание необходимо назначать после компенсации гемодиначеских расстройств после проведения инфузионной терапии. По возможности энтеральное питание должно проводиться через еюнальный зонд, проведённый в тонкий кишечник. Уровень доказательности 1а, категория А.
Рекомендация 10. Парентеральное питание назначают после того, как энтеральное питание оказывается неэффективным в течение 5-7 дней использования. Уровень доказательности 5, категория D.
Рекомендация 11. При назначении парентерального питания следует отдавать предпочтение средам, богатым глутамином. Уровень доказательности 5, категория D.
Рекомендация 12. У пациентов, получающих парентеральное и энтеральное питание, необходимо обязательно контролировать уровень глюкозы в крови. Уровень доказательности 1b, категория А.
Рекомендация 13. Не рекомендуется рутинное использование для энтерального питания составов, содержащих иммуномодуляторы и пробиотики. Уровень доказательности 5, категория D.
IV. Каковы показания для оперативного вмешательства при остром панкреатите, оптимальное время проведения вмешательства, каково значение малоинвазивных хирургических процедур, как, например, чрескожное дренирование и лапароскопия?
Рекомендация 14. Рекомендуется тонкоигольная аспирационная биопсия под УЗИ или КТ-контролем с окраской по Граму и культуральным исследованием полученного материала у пациентов с рентгенологическими признаками панкреонекроза и клиническими признаками инфицирования.
Рекомендация 15. У пациентов с не-инфицированным панкеронекрозом не рекомендуется выполнять некрэктомию и/или дренирование. Уровень доказательности 4, категория С.
Рекомендация 16. Хирургическая некрэктомия и дренирование рекомендованы у пациентов с инфицированным панкреонекрозом и/или при наличии абсцесса, подтверждённого рентгенологически наличием свободного газа или по данным исследования с помощью тонкоигольной аспирационной биопсии. «Золотым стандартом» считается открытая хирургическая некрэктомия. У некоторых категорий пациентов возможно использование малоинвазивных процедур, таких как лапароскопическое и/или чрескожные вмешательства. Уровень доказательности 4, категория С.
Рекомендация 17. Показаны отсроченное выполнение (2-3 недели) оперативной некрэктомии и/или дренирование для обеспечения лучшей демаркации некротизированных участков поджелудочной железы. Однако приоритетными показаниями для времени проведения оперативного вмешательства должны являться клиническая картина (тяжесть и динамика симптомов). Уровень доказательности 4, категория С.
V. При каких обстоятельствах пациентам с билиарным панкреатитом показано хирургическое удаление камней из желчных путей?
Рекомендация 18. Билиарный панкреатит следует подозревать у всех пациентов с тяжёлым острым панкреатитом, поэтому у этой категории больных необходимо проводить исследование с помощью ультразвука и биохимические тесты. Уровень доказательности 4, категория С.
Рекомендация 19. В случае наличия обструктивной желтухи (или других признаках обструкции желчевыводящих путей и/или протоков поджелудочной железы) и остром билиарном панкреатите, подтверждённым или подозреваемым, рекомендовано проведение ЭРХПГ в течение 72 ч после появления симптомов. Если по техническим причинам невозможно проведение ЭРХПГ, необходимо воспользоваться альтернативными методами дренирования желчных протоков. Уровень доказательности 5, категория D.
Рекомендация 20. При отсутствии обструктивной желтухи, но при наличии тяжёлого острого панкреатита, развившегося вследствие подозреваемого или подтверждённого холелитиаза, ЭРХПГ необходимо провести в течение 72 ч после первого появления симптомов. Уровень доказательности 1с, категория B.
VI. Существуют ли доказательные данные для назначения противовоспалительной терапии у пациентов с ТОП?
Рекомендация 21. Необходимо раннее назначение инфузионной терапии для восполнения объёма циркулирующей крови (уровень доказательности 1b, категория А) и мероприятия для устранения дыхательной недостаточности у пациентов с острым респираторным дистресс-синдромом (уровень доказательности 1b, категория А).
Рекомендация 22. После подтверждения или высокой вероятности инфицирования панкреонекроза, лечение следует осуществлять в соответствии с современными рекомендациями по лечению пациентов с сепсисом. Среди новых лекарственных средств и режимов используют активированный рекомбинантный протеин С (дротрекогин альфа) (уровень доказательности 1b, категория А) и низкие дозы глюкокортикоидов для коррекции шока (уровень доказательности 1b, категория В).
Рекомендация 23. Иммуномодуляторы, такие как TNF-альфа и лексипафант, не рекомендуются для использования у данной категории пациентов. Уровень доказательности 5, категория D.
Nathens A.B., Curtis J.R., Beale R.J., Cook D.J., Moreno R.P., Romand J.A., Skerrett S.J., Stapleton R.D., Ware L.B., Waldmann C.S.
Management of the critically ill patient with severe acute pancreatitis.
Crit Care Med. 2004; 32: 2524-2536.
33516
тяжёлый острый панкреатит, практические рекомендации, отделения реанимации и интенсивной терапии, ОРИТ
Источник
Е.А. ГАЛОВА, к.м.н., ФГБУ «Нижегородский научно-исследовательский институт детской гастроэнтерологии» Минздрава России, Нижний Новгород
Представлены данные об актуальных вопросах терапии хронического панкреатита у взрослых. Особое внимание уделено применению ферментных препаратов в качестве заместительной и симптоматической терапии при хроническом панкреатите. Представлена краткая характеристика спазмолитиков, используемых для купирования абдоминальной боли при хроническом панкреатите.
Термином «хронический панкреатит» (ХП) обозначают группу хронических заболеваний поджелудочной железы (ПЖ) различной этиологии, преимущественно воспалительной природы, с фазово-прогрессирующими очаговыми, сегментарными или диффузными дегенеративными, деструктивными изменениями ее экзокринной части, атрофией железистых элементов (панкреоцитов) и замещением их соединительной (фиброзной) тканью; изменениями в протоковой системе ПЖ с образованием кист и конкрементов, с различной степенью нарушения экзокринной и эндокринной функций.
Следует отметить высокую и ежегодно возрастающую распространенность и заболеваемость данной патологией (C.Ю. Сереброва, 2008). Так, в индустриально развитых странах заболеваемость хроническим панкреатитом колеблется от 49,5 до 73,4 случая на 100 тыс. населения в год. В России распространенность хронического панкреатита составляет среди взрослого населения 27,4–50 случаев на 100 тыс. населения (Н.С. Живаева и соавт., 2007; О.Н. Минушкин, 2007).
Полиэтиологичность, патогенетическая неоднородность и прогрессирующий характер течения хронического панкреатита, сопровождающегося функциональной экзо-, эндокринной недостаточностью поджелудочной железы, развитием осложнений, определяют актуальность вопросов своевременной диагностики и адекватной терапии заболевания (рис. 1., табл. 1, 2) [1–4].
Принципиально важным является выделение аутоиммунного панкреатита, развивающегося при иммунозависимых заболеваниях (первичный билиарный цирроз печени, первичный склерозирующий холангит, воспалительные заболевания кишечника, синдром Шегрена и др.) или являющегося самостоятельной формой болезни с селективным поражением ПЖ, терминального отдела холедоха и группы наследственных заболеваний, сопровождающихся поражением поджелудочной железы (муковисцидоз, наследственный панкреатит), характеризующихся ранней клинической манифестацией, быстрым прогрессированием и высоким риском развития рака ПЖ [5].
Успех лечения больных хроническим панкреатитом напрямую зависит от своевременной диагностики заболевания, установления его этиологии и выявления осложнений, прогнозирования возможных исходов болезни, наличия (часто) или отсутствия сопутствующей патологии органов пищеварения, имитирующей и/или усугубляющей течение болезни.
Терапия хронического панкреатита является комплексной, проводится на фоне создания условий для уменьшения (до минимума при обострении заболевания) функциональной активности поджелудочной железы (в т. ч. терапевтическими средствами); дробного, лечебного питания; заключается в оценке возможностей этиотропного и патогенетического купирования болевого синдрома, коррекции экзо- и эндокринной недостаточности поджелудочной железы; предотвращении рецидивирования болезни при сохраняющемся причинном факторе [6, 7].
Доминирующим (до 90% случаев) и наиболее ярким проявлением хронического панкреатита является абдоминальный болевой синдром. Выраженность боли может варьировать от полного ее отсутствия до постоянной, нестерпимой боли, приводящей к частым госпитализациям и инвалидизации больного.
Боли при хроническом панкреатите обусловлены многофакторными воздействиями: воспалением (паренхимы, капсулы и нервных окончаний), ишемией (при вовлечении в воспалительный процесс кровеносных сосудов), обструкцией протоков поджелудочной железы с развитием гипертензии, прогрессирующим фиброзом ПЖ со сдавлением нервных образований, внешне- и внутрипанкреатическими осложнениями и др. Универсальным патофизиологическим эквивалентом боли служит спазм гладких мышц стенки панкреатических и желчных протоков.
Современные спазмолитические препараты представлены различными группами лекарственных средств, способных воздействовать на разные механизмы спастического сокращения гладкой мускулатуры органов пищеварения.
По механизму действия выделяют миотропные спазмолитики, напрямую (неселективно) влияющие на биохимические процессы в гладкомышечных клетках (альверина цитрат, дротаверина гидрохлорид, папаверина гидрохлорид) либо избирательно (селективно) действующие на отдельные гладкомышечные органы (пинавериум бромид, мебеверина гидрохлорид), и нейротропные (блокаторы М-холинорецепторов) лекарственные средства, нарушающие передачу нервных импульсов в вегетативных ганглиях или окончаниях вегетативных нервов: неселективные (атропина сульфат, гиосцина бутилбромид) и селективные (пирензепин гидрохлорид).
При выборе спазмолитического препарата следует помнить, что неселективные миотропные спазмолитики могут вызвать системные действия в виде сердцебиения, чувства жара, снижение артериального давления, а неселективные М-холиноблокаторы, наряду с анальгетическим, имеют ряд нежелательных эффектов в виде ухудшения зрения, сухости во рту, тахикардии, задержки мочи, слабости, нарушений двигательной функции желудочно-кишечного тракта (гипермоторную дискинезию и гипотонию сфинктерного аппарата), играющих значительную роль в формировании болевого синдрома и большинства диспепсических расстройств (чувство переполнения в желудке, отрыжка, изжога, тошнота, рвота, метеоризм, поносы, запоры). Кроме того, необходимо помнить о противопоказаниях к назначению неселективных М-холиноблокаторов (тахиаритмии, глаукома, аденома предстательной железы и др.).
Таким образом, при выборе спазмолитического средства предпочтение следует отдавать миотропным спазмолитикам селективного действия и селективным М-холиноблокаторам, обладающим способностью блокировать желудочную и панкреатическую секрецию, регулировать гастроинтестинальную моторику, снижать тонус сфинктера Одди и даже улучшать микроциркуляцию в ПЖ, однако нужно помнить об ограничении их применения в случае дуоденостаза.
Алгоритм снятия болевого синдрома во многом определяется его интенсивностью и длительностью. Ведущим механизмом, поддерживающим болевые ощущения при торпидности к проводимому лечению и продолжительности боли, становится нарушение восприятия последней (процесс ноцицепции), значительная дезадаптация ноцицептивных структур центральной нервной системы и, как следствие, психопатологическая симптоматика [8, 9].
Экспертами ВОЗ рекомендован пошаговый алгоритм снятия болевого синдрома при хроническом панкреатите с использованием блокаторов серотониновых рецепторов, психотропных средств, ненаркотических анальгетиков и опиодиов (табл. 3) [1].
Установлено, что купирование болей особенно эффективно при сочетании инъекций блокаторов М-холинорецепторов и ненаркотических анальгетиков.
В настоящее время наибольшего применения в лечения ХП с болевым синдромом нашли два, не имеющих существенных различий алгоритма, ориентирующих врача на выбор оперативной или консервативной терапии заболевания по результатам диагностических тестов. Первый из них рекомендован Американской гастроэнтерологической ассоциацией, второй разработан S.T. Amann и P.P. Toskes в университете Флориды [10, 11].
Согласно обоим алгоритмам для усиления обезболивания целесообразно назначение полиферментных препаратов с высокой протеолитической активностью в сочетании с антисекреторными средствами. Анальгетический эффект в данном случае обеспечивается посредством дуоденопанкреатического механизма «обратной связи» и обеспечения функционального покоя железы (рис. 2).
Применение микрокапсулированных/микротаблетированных энтеросолюбильных препаратов панкреатина с высоким содержанием протеаз в терапии абдоминального болевого синдрома при хроническом панкреатите уже давно доказало свою высокую эффективность [17, 18]. Кроме того, установлена прямая зависимость между степенью уменьшения болевого синдрома и степенью подавления панкреатической секреции; дозой ферментного препарата и динамикой купирования болевого синдрома [19]. Анальгетический эффект микрокапсулированных/микротаблетированных ферментных препаратов обеспечивается не только сбалансированным составом, достаточной суммарной протеазной активностью, активностью трипсина/химотрипсина в ферментном препарате, но и высокой их ферментативной стабильностью, сохранением активности в кислом содержимом.
Не менее значимым и трудным при хроническом панкреатите является лечение внешнесекреторной панкреатической недостаточности. Коррекция экзокринных нарушений ПЖ осуществляется путем длительной (от многих месяцев до пожизненной) заместительной терапии ферментными препаратами (ФП) и должна проводится в комплексе с мероприятиями специфической нутритивной поддержки с включением антиоксидантных и витаминно-минеральных лекарственных средств [21].
Основой большинства ферментных препаратов является амилаза, протеазы, липаза животного происхождения, содержащиеся в панкреатине из поджелудочной железы свиней. Липаза гидролизует нейтральный жир, амилаза расщепляет внеклеточные полисахариды — крахмал, гликоген, но не участвует в переваривании растительных оболочек, протеазы, основным из которых является трипсин, расщепляют белки.
Активность ферментных препаратов оценивают по активности липазы в стандартных международных единицах — Ед FIP (Federation International Pharmaceutical Unit) или в единицах Европейской фармакопеи — Ед Ph. Eur. (Pharmacopea of Europe). Липазная активность 1 мг сухого панкреатина колеблется от 17 до 40 и выше Ед FIP.
Для обеспечения нормального процесса пищеварения необходимо создание в двенадцатиперстной кишке такого содержания ферментов, которое составляет 5–10% от выделяющихся при максимальной стимуляции поджелудочной железы у здоровых.
При прогрессирующей недостаточности ацинарной ткани и развитии экзогенной недостаточности поджелудочной железы наиболее часто развивается недостаточность панкреатической липазы ввиду ее значительной (в сравнении с амилазой и протеазами) инактивации протеолитическим гидролизом, отсутствия возможности компенсирования липазой других органов (кишечника, слюнных желез) и быстрого разрушения в кислой среде.
В настоящее время не подвергается сомнению необходимость назначения микротаблетированных (микрокапсулированных) ферментных препаратов вследствие их высокой специфической липазной активности, оптимальной сбалансированности по составу амилазы и протеаз, устойчивости к действию желудочного сока, быстрой эвакуации из желудка и смешивания с химусом, короткого времени растворения энтеросолюбильной оболочки в тонкой кишке и активного включения в процессы полостного пищеварения.
Следует помнить о группах ферментных препаратов, противопоказанных и имеющих ограничения к использованию в лечении хронического панкреатита.
Так, противопоказаны пищеварительные ферменты, в состав которых включены компоненты желчи. При сочетании хронического панкреатита с гиперкинетическим типом дисфункции желчного пузыря, дуоденогастральным рефлюксом, гипербилирубинемией и при наличии признаков кишечной непроходимости их назначение не оказывает терапевтического эффекта, а может приводить к ухудшению состояния больного.
Целесообразно ограничивать применение энзимных средств, содержащих компоненты слизистой оболочки желудка, ввиду возможности стимулирования секреции поджелудочной железы.
Ферментные препараты, содержащие гемицеллюлозу, создают оптимальные условия для быстрого и полного расщепления белков, жиров и углеводов в двенадцатиперстной и тощей кишках. Однако усиление моторики желудочно-кишечного тракта под действием гемицеллюлозы свидетельствует о нецелесообразности использования ферментных средств, ее содержащих, при сопутствующей гиперкинетической дисфункции желчного пузыря, дуоденогастральном/гастроэзофагеальном рефлюксах, признаках кишечной непроходимости и у пациентов со склонностью к учащенному стулу в силу возможности развития диареи.
Выбор ферментного препарата следует осуществлять, ориентируясь на его сигнатурную липазную активность, исходя из клинической картины заболевания и данных лабораторных методов обследования, позволяющих установить уровень экскреции жира с калом. В настоящее время широкое распространение получил эластазный тест (по показателю эластазы-1 в кале). Так, нормальное (более 200 мкг/г) содержание последней свидетельствует о целесообразности применения на старте терапии 50 тыс. Ед, умеренная недостаточность (100–200 мкг/г) – до 100 тыс. Ед, выраженная недостаточность – до 150 тыс. Ед липазы в сутки.
Критерием эффективности заместительной терапии является уменьшение выраженности диспептического синдрома, в т. ч. купирование диареи и стабилизация массы тела.
Длительность назначения ферментных препаратов при обострении хронического панкреатита составляет, как правило, не менее 5 нед., а полную ремиссию заболевания удается достичь не ранее чем через 6–12 мес.
Недостаточная эффективность заместительной терапии или ее отсутствие может быть обусловлено рядом причин, которые следует выявить и по возможности устранить.
Правильный выбор ферментного препарата, грамотный подбор стартовой дозы, своевременный прием лекарства и достаточная его кратность (во время каждого приема пищи) с регулярной врачебной оценкой комплаентности способствуют предупреждению недостаточной эффективности лечения вследствие неадекватного назначения (низкая доза или неправильный выбор) или несоблюдения больным схемы приема энзимного средства.
Своевременное выявление сопутствующих состояний/заболеваний, сопровождающихся внепанкреатической стеатореей (целиакия, лямблиоз, синдром избыточного бактериального роста) с последующей их коррекцией (аглютеновая диета, дегельминтизация, санация кишечника антисептиками и антибактериальными средствами), также способствует повышению эффективности заместительной терапии при хроническом панкреатите.
Комбинирование ферментных лекарственных средств с антисекреторными препаратами (ингибиторы протонной помпы) позволяет избежать отсутствия эффективности заместительной энзимотерапии терапии в случае ацидификации двенадцатиперстной кишки (гастринома, выраженное снижение секреции желчи и панкреатических бикарбонатов).
Таким образом, при лечении хронического панкреатита следует руководствоваться имеющимися накопленными научными знаниями. Терапевтический подход должен осуществляться индивидуально с учетом выраженности болевого абдоминального синдрома, степени экзокринной, трофологической недостаточности и эндокринных расстройств. Своевременное и адекватное назначение терапии и выполнение больным предписанных врачом рекомендаций во многом определят прогноз течения и исход заболевания.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Гастроэнтерология и гепатология: диагностика и лечение: руководство для врачей / под ред. А.В. Калинина, А.Ф. Логинова, А.И. Хазанова. – 2-е изд., перераб. и доп. – Москва: МЕДпресс-информ, 2011. – 864 с.: ил.
2. Циммерман, Я.С. Хронический холецистит и хронический панкреатит (Очерки клинической гастроэнтерологии). Выпуск второй. – Пермь: Перм. гос. мед. Академия, 2001. – 252 с.
3. Винокурова, Л.В. Клинико-патогенетические механизмы развития внешне- и внутрисекреторной недостаточности при хроническом панкреатите: автореф. дис. … докт. мед. наук. Москва: 2009., 42 с.
4. Токарева, Е.В. Сравнительная оценка тяжести течения, состояние экскреторной функции поджелудочной железы и микробиоценоза кишечника у больных хроническим панкреатитом различной этиологии: автореф. дис. … канд. мед. наук. Пермь: 2011., 27 с.
5. Chari, S.T. Diagnosis of autoimmune pancreatitis: the Mayo Clinic experience / S.T. Chari, T.C. Smyrk, M.J. Levy [et al.] // Clin. Gastroenterol. Hepatol. – 2006. — №4. – р. 1010-1016.
6. Маев, И.В. Хронический панкреатит: Алгоритм диагностики и лечебной тактики / И.В. Маев, А.Н. Казюлин, А.А. Самсонов, Ю.А. Кучерявый. Пособие для врачей общей практики, терапевтов, гастроэнтерологов: Учебное пособие. – М.: ГОУ ВУНМЦ МЗ и СР РФ, 2006. — 37с.
7. Шифрин, О.С. Особенности лечебной тактики у больных хроническим панкреатитом среднетяжелого течения различной этиологии: автореф. дис. … докт. мед. наук. Москва: 2008., 44 с.
8. Пахомова, И.Г. Клинико-психосоматические особенности и качество жизни больных рецидивирующей формой хронического панкреатита, сочетающегося с гипертонической болезнью: автореф. дис. … канд.мед.наук. Спб., 2003.
9. Успенский, Ю.П. Синдром абдоминальной боли в гастроэнтерологической практике (анализ проблемы) / Ю.П. Успенский, И.Г. Пахомова // Клин. перспективы гастроэнтерол. гепатологии. – 2007. — №5. – с. 21-31.
10. AGA Technical Review: Treatment of Pain in Chronic Pancreatitis // Gastroenterology. – 1998. — №115. – р. 765-776.
11. Охлобыстин, А.В. Алгоритмы ведения больных острым и хроническим панкреатитом / А.В. Охлобыстин, В.Т. Ивашкин // Consilium medicum. – 2000. – Т.2, №7. – с. 279 – 286.
12. Калинин, А.В. Лечение хронического панкреатита ферментными препаратами / А.В. Калинин, Е.А. Джанашия // Consilium medicum. – 2005. – Т.7., N 6. – С. 448-451.
13. Кучерявый, Ю.А. Пациент с хроническим панкреатитом: ошибки ведения, возможные причины и пути решения / Ю.А. Кучерявый // Consilium medicum. – 2011. — N 1. – С. 46-51.
14. Ihse, I. Feedback regulation of pancreatic enzyme secretion by intestinal trypsin in man / I.Ihse, P.Lilja, I.Lundquist // Digestion. – 1977; 15: 303.
15. Slaff, J.I. Protease-specific suppression of pancreatic exocrine secretion / J.I.Slaff, D.Jacobson, C.R. Tillman [et al.] // Gastroenterology. — 1984; 87: 44.
16. Isakson, G. Pain reduction by an oral pancreatic enzyme preparation in chronic pancreatitis / G.Isakson, I.Ihse // Dig Dis Sci. — 1983; 28: 97 – 102.
17. Клинические лекции по гастроэнтерологии и гепатологии. Т.2. Болезни кишечника и поджелудочной железы. Под ред. А.В. Калинина, А.И. Хазанова. М.: ГТУВ МО РФ, 2000; 325 с.
18. Краткое руководство по гастроэнтерологии. Под ред. В.Т. Ивашкина, Ф.И. Комарова, С.И. Рапопорта. М.: ООО «Изд.дом «М-Вести», 2001.
19. Ивашкин, В.Т. Эффективность микрокапсулированных ферментов, покрытых энтеросолюбильной оболочкой, при хроническом панкреатите / В.Т. Ивашкин, А.В. Охлобыстин, Н. Баярмаа // Клин. персективы гастроэнтерол. гепатол. — 2001. — № 5. – С. 15 – 19.
20. Хвостова, Т.С. Сравнительная биохимическая характеристика патентованных препаратов ферментозаместительной терапии в астроэнтерологии: дис….канд.мед.наук: 03.00.04 / Хвостова Татьяна Станиславовна. – Краснодар, 2003. – 137 с.
21. Строкова, О.А. Состояние кишечного пищеварения у больных хроническим панкреатитом: автореф. дис. … канд. мед. наук. Ульяновск: 2009., 18 с.
Источник