Стеариновые бляшки при панкреатите
ЖИРОВЫЕ НЕКРОЗЫ (син.: стеариновые бляшки, некроз жировой ткани) — очаговые омертвения жировой ткани.
Термин введен в 1882 г. Бальзером (W. Balser), который описал 5 случаев некроза жировой клетчатки как в ткани, так и в окружности поджелудочной железы. Аналогичные наблюдения были описаны ранее Смиттом (Smitt, 1818), Р. Вирховом (1852), Понфиком (E. Ponfick, 1872).
Этиология и патогенез
Этиология и патогенез Ж. н. окончательно не выяснены. Можно лишь утверждать, что Ж. н. представляют собой конечную фазу сложного хим. процесса, в к-ром действие панкреатической липазы занимает ведущее место. Электронно-микроскопические исследования свидетельствуют о том, что в определенных ситуациях (преимущественно жировая диета, злоупотребление алкоголем) гранулы зимогена элиминируются не только в систему выводных протоков железы, но и в перицеллюлярное пространство. Активная липаза током тканевой жидкости достигает междольковой жировой ткани и некротизирует ее: возникает так наз. дистанционный некроз. В очагах Ж. н. при гистохимическом исследовании отмечается высокая активность липазы. Попадая в сосудистое русло, активная липаза может вызвать Ж. н. в отдаленных от поджелудочной железы участках жировой ткани.
К ферментам, обладающим цитотоксическим действием на жировую ткань, причисляют амилазу и лецитиназу, фосфолипазу А, липазу жировой ткани. Большое значение в патогенезе Ж. н. приписывают липолизу, в основе к-рого лежит гидролитическое расщепление триглицеридов (нейтральных жиров) на глицерин и жирные к-ты. Активность липазы регулируется циклическим 3′,5′-аденозинмонофосфатом (3′,5′-АМФ). Содержание 3′,5′-АМФ в ткани зависит от активности двух ферментов — аденилатциклазы и фосфодиэстеразы. Аденилатциклаза катализирует образование циклического 3′,5′-АМФ из АТФ. Некоторые гормоны (глюкагон и АКТГ) стимулируют активность аденилатциклазы и, т. о., увеличивают образование 3′,5′-АМФ и последующий липолиз жировой ткани.
Среди процессов, способствующих липолизу жировой ткани, первое место отводят острому панкреатиту. При экспериментальном панкреатите у крыс в течение первых 3 час. отмечался выраженный липолиз, а через 3—6 час. в этих участках значительно увеличивалось содержание кальция. Высвободившиеся при этом жирные к-ты эстерифицируются кальцием, а образовавшиеся таким путем кальциевые мыла осаждаются и представляют основу так наз. Ж. н. Инсулин с глюкозой, никотиновая к-та и пропранолол (бета-адренергический блокирующий агент) ингибируют липолиз.
Ж. н. представляют собой очаги, напоминающие по внешнему виду стеариновые капли (отсюда название «стеариновые бляшки»), округлой формы, плотной консистенции, диам. 1 — 3 мм. Нередко Ж. н., сливаясь, образуют более крупные очаги диаметром до 1 см и более. Локализуются они чаще в поджелудочной железе и жировой клетчатке брюшной полости (большой и малый сальник, брыжейка тонкой кишки, забрюшинная клетчатка, клетчатка малого таза). Во внутренних органах (кроме поджелудочной железы) Ж. н. не наблюдаются. Из других локализаций следует указать на подкожную клетчатку туловища и конечностей, перикард, плевру, брюшину, костный мозг.
Для макроскопической диагностики Ж. н. применяют реакцию Бенды, с помощью к-рой они окрашиваются в зеленый цвет.

Микроскопическая картина очага жирового некроза в поджелудочной железе: 1 — край дольки поджелудочной железы; 2 — демаркационный клеточный вал; 3 — некротизированная масса.
При микроскопическом исследовании в очаге Ж. н. цитоплазматическая мембрана жировых клеток неразличима, ядра клеток отсутствуют и очаг представлен гомогенной некротизированной массой (рис.). Микроскопически можно проследить динамику развития Ж. н., к-рая складывается из последовательного развития дистрофических, некробиотических и в конечном итоге некротических изменений жировых клеток; в очагах жировых некрозов обнаруживаются различные кристаллические включения. По периферии очага Ж. н. располагается демаркационный клеточный вал, представленный лимфоцитами, полиморфно-ядерными лейкоцитами, макрофагами и плазматическими клетками. Клеточный инфильтрат способствует рассасыванию некротических масс, а образующаяся грануляционная ткань формирует капсулу (инкапсуляция очага Ж. н.). Если в инкапсулированный очаг откладываются соли кальция, то наступает обызвествление (кальцификация).
Клин, симптоматика Ж. н. в основном обусловлена поражением поджелудочной железы (см. Панкреатит). Одиночные непанкреатогенные Ж. н. (напр., подкожной клетчатки) могут существовать бессимптомно и со временем обызвествляться. Возможно также нагноение их с развитием абсцесса (см.). Последний может явиться причиной перитонита, псевдокист поджелудочной железы или свищей между полостью абсцесса и полым органом (желудок, тонкая или толстая кишка), а также аррозии стенок сосудов с последующим кровотечением. Распространенные Ж. н. корня брыжейки и боковых каналов брюшной полости значительно осложняют течение панкреатита, способствуют развитию спаечной непроходимости кишечника (см.), а в случаях присоединения инфекции — диффузного гнойного перитонита.
В связи с тем, что в подавляющем большинстве случаев Ж. н. являются следствием панкреатита, в основе их профилактики и лечения лежат меры предупреждения и терапии этого заболевания. Для предупреждения абсцедирования Ж. н. рекомендуется антибактериальная терапия, а в случае сформировавшихся гнойников — их вскрытие и дренирование.
Библиография: Лобачев С. В. Острые панкреатиты, М., 1953, библиогр.; Пeрмяков Н. К. и Подольский А. Е. О патогенезе панкреатита, Хирургия, JsTs 9, с. 23, 1973; Пермяков Н. К., Подольский А. Е. и Титова Г. П. Ультраструктурный анализ секреторного цикла поджелудочной железы, М., 1973, библиогр.; AkgtinS. a. RudmanD. Relationships between mobilization of free fatty acids from adipose tissue and the concentrations of calcium in the extracellular fluid and in the tissue, Endocrinology, v. 84, p. 926, 1969; E f e n d i 6 S., Aim B. a. L б w H. Effect of Ca++ on lipolysis in human omental adipose tissue in vitro, Horm. Metabol. Res., v. 2, p. 287, 1970; S t о г с k G. Fat necrosis in acute pancreatitis, Acta chir. scand., Suppl. 417, 1971; Theve N. O. Fat necrosis, ibid., Suppl. 434, 1972.
H. K. Пермяков.
Источник
В эксперименте на моделях ОП установлено, что образование трипсина может происходить как внутри ацинарных клеток путем слияния гранул зимогена с вакуолями лизосом и последующим воздействием на трипсиноген катепсина B (лизосомальной гидролазы), так и внеацинарно благодаря действию освобождающихся при разрушении клеток цитокиназ на попадающие в межклеточное пространство гранулы зимогена. При накоплении трипсина в тканях выше определенного критического уровня, превышающего суммарные защитные возможности ингибирующей системы организма, включающей a1-антитрипсин и b2-макроглобулин, запускается аутокаталитический каскад переваривания ПЖ (рис. 7).
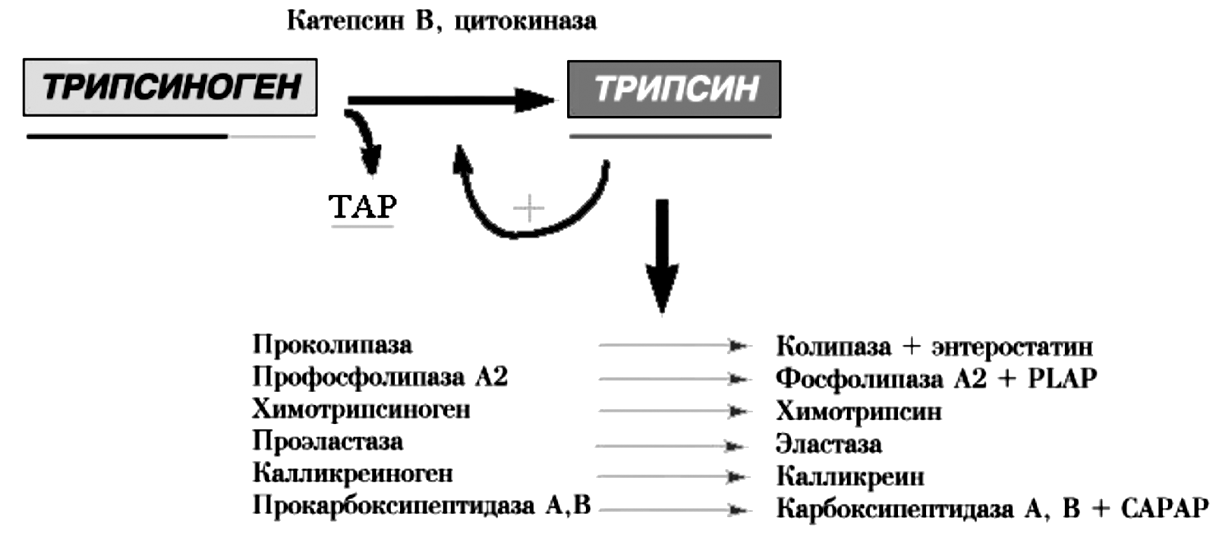
Рис. 7. Аутокаталитический каскад при остром панкреатите
Экспериментально установлено, что трипсин в достаточно больших дозах самостоятельно способен вызывать некроз тканей, который, однако, по морфологической картине отличается от наблюдаемого клинически. В связи с этим считают, что важную роль в патогенезе ОП играют и другие активируемые трипсином ферменты. Химотрипсин и эластаза, подобно трипсину, при изолированном действии вызывают отек, геморрагии и ограниченный некроз. Фосфолипаза А2 с присущими ей выраженными цитолитическими свойствами повреждает клеточные мембраны, высвобождая лизолецитин, который обладает цитотоксическим действием. Считается, что фосфолипаза ответственна также за острое повреждение легких в связи с деградацией сурфактанта. Активация эластазы ведет к разрушению эластичных компонентов сосудов, способствуя внутрипанкреатическим кровоизлияниям. Активированная липаза вызывает жировой некроз перипанкреатической клетчатки, детергенты, выделяемые при жировом некрозе, могут оказывать прямое токсическое действие на ацинарные клетки. В связи с этим тучность является отягощающим фактором в отношении тяжелого панкреатита. Таким образом, активированные ферменты ПЖ выступают в качестве факторов агрессии первого порядка, оказывая как местное, так и системное действие.
Важным звеном патогенеза ОП является активация калликреин-кининовой системы с образованием факторов агрессии второго порядка. Так, трипсин активирует комплемент и кинин, вызывающие внутрисосудистую коагуляцию, шок, почечную недостаточность. Активация циркулирующим трипсином калликреина приводит к высвобождению брадикинина и каллидина, обладающих вазоактивным эффектом, следствием которого являются сосудистые нарушения, ведущие к некрозу.
Существенную роль в патогенезе системной воспалительной реакции при ОП играет некоординированный синтез воспалительных медиаторов (факторов агрессии третьего порядка) мононуклеарными клетками и нейтрофилами: интерлейкинов 1, 6, 8, 12, простагландинов, тромбоксана, лейкотриенов, фактора некроза опухоли, тромбоцит-активирующего фактора.
Одной из наиболее частых причин ОП (до 45% случаев) служит алкоголь. В отношении механизма его патологического действия на ПЖ существуют три гипотезы:
- первая — непосредственное токсическое повреждение ацинарных клеток этанолом или его метаболитом ацетальдегидом, которые поступают в ПЖ с током крови;
- вторая — образование протеиновых пробок в протоках железы;
- третья — изменение состава желчи за счет образования высокореактивных свободных радикалов и прямого токсического воздействия на клетки при одновременном повышении давления в протоках.
Примерно у 35% больных выявляется билиарный панкреатит. При этом наиболее распространенной является патогенетическая теория «общего канала». Согласно этой теории особенности анатомического соотношения, существующие между общим желчным протоком и ГПП, способствуют рефлюксу желчи, что ведет к активации ферментов внутри протоков и развитию ОП. Забросу желчи в вирсунгов проток способствует закупорка ампулы БДС, причины которой могут быть самые разные (желчные камни, опухоли ПЖ, метастазы опухолей других органов, метаплазия эпителия протока и др.).
Наиболее часто наблюдается закупорка желчными камнями, причем установлена зависимость развития заболевания от размера желчных камней (чаще при диаметре камней менее 5 мм) и связанной с этим возможностью их продвижения в общий желчный проток. Имеются данные о том, что от 2/3 до 3/4 идиопатических случаев ОП фактически связаны с закупоркой желчными микролитами и осадком. Образованию желчных осадков способствуют полное парентеральное питание, беременность, трансплантация костного мозга, синдром приобретенного иммунодефицита и др.
Значительное внимание в этиологии ОП уделяется действию лекарственных препаратов. Имеются сообщения о развитии ОП после приема 85 лекарственных препаратов разной химической структуры, однако доказательства их связи с развитием заболевания не всегда достаточны, а механизмы действия не установлены.
Таким образом, в настоящее время нет единого представления об этиологии и патогенезе ОП.
Mногочисленные клинические и экспериментальные исследования указывают на возможность развития данного заболевания под воздействием самых разных причин. Вместе с тем, вопрос о том, каким образом эти причины вызывают более или менее сходные патологические изменения в ПЖ, проявляющиеся в виде ОП, не всегда понятен. Окончательное выяснение механизмов развития ОП требует дальнейших исследований, от результатов которых в значительной мере зависит успешное решение практической задачи — выбор рациональной лечебной тактики.
3.3. Морфогенез
По характеру и распространенности местных патологических изменений ОП существенно отличается от других острых заболеваний брюшной полости. При ОДП деструктивно-воспалительные изменения обнаруживаются не только в ПЖ (собственно панкреатит), но и в забрюшинной клетчатке (парапанкреатит), в брюшной полости (перитонит), в большом и малом сальниках (оментит), сальниковой сумке (оментобурсит), жировых подвесках ободочной кишки (эпиплоит), связках брюшины (лигаментит). Нередко панкреатические ферменты повреждают и желчный пузырь, приводя к развитию ферментативного острого холецистита (рис. 8).
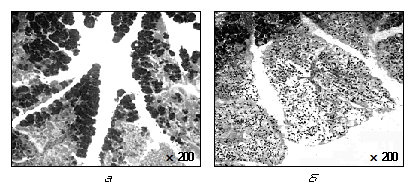
Рис. 8. Микропрепараты ткани ПЖ при отечной форме ОП (а) и панкреонекрозе (б)
В развитии морфологических изменений при ОП выделяют 4 фазы:
- I фаза — ферментативная;
- II фаза — реактивная;
- III фаза — секвестрации;
- IV фаза — исходов.
При этом необходимо отметить, что фазовое течение ОП не означает, что одна фаза обязательно должна переходить в последующую, а также не подразумевает строгую очерченность процесса во времени и протяженность поражения ПЖ. Каждая более легкая фаза может закончиться обратным развитием, без перехода в более тяжелую. Только значительные изменения ПЖ и забрюшинной клетчатки характеризуются наличием всех фаз развития ОП.
1-й ферментативной фазе (1-я неделя заболевания) соответствуют две морфологические формы ОП: отечный (интерстициальный) ОП и деструктивный ОП (панкреонекроз).
Отечный панкреатит наблюдается в 75—80% случаев и характеризуется умеренным отеком ткани ПЖ, ее уплотнением. Дольчатость органа сохраняется, отсутствуют участки геморрагической имбибиции и значительной экссудации в брюшную полость (см. рис. 8, а).
Жировой панкреонекроз характеризуется увеличением в размерах ПЖ, резким отеком с исчезновением дольчатости ее структуры; много участков геморрагий, пятен стеатонекроза в ПЖ, забрюшинной клетчатке, брыжейках, подкожной клетчатке, средостении. Пятна стеатонекроза, или «стеариновые бляшки», — это мелкие, плоские белесовато-желтого цвета образования. Возникновение их обусловлено воздействием липолитических ферментов на нейтральные жиры тканей с образованием жирных кислот и глицерина. Жирные кислоты, соединяясь с ионами кальция из разрушенных сосудов, образуют «стеариновые бляшки».
Геморрагический панкреонекроз имеет наиболее яркие проявления. В ПЖ и окружающих тканях — обширные участки кровоизлияний, зоны серого и черного цвета, начинающаяся секвестрация ткани ПЖ. Эти изменения сочетаются с наличием «бляшек» жирового стеатонекроза. В брюшной полости — геморрагический выпот, содержащий активные ферменты и токсины (см. рис. 8, б).
Источник
Острый панкреатит — это воспалительно-некротическое поражение поджелудочной железы, в основе которого лежат процессы ферментного аутолиза («самопереваривания») панкреатоцитов с последующим развитием некроза, дегенерации железы и возможным присоединением вторичной инфекции.
Классификация (по Савельеву В.С.).
Формы острого панкреатита:
Отечный панкреатит.
Стерильный панкреонекроз:
по характеру поражения: жировой, геморрагический, смешанный;
по масштабу поражения: мелкоочаговый, крупноочаговый, субтотальный, тотальный.
Осложнения острого панкреатита включают: парапанкреатический инфильтрат, инфицированный панкреонекроз, панкреатогенный абсцесс, псевдокисту, панкреатогенный ферментативный асцит-перитонит, инфицированный перитонит, септическую флегмону забрюшинной клетчатки, механическую желтуху, аррозивное кровотечение, внутренние и наружные дигестивные свищи.
Этиология и патогенез. Острый панкреатит возникает из-за нарушения оттока панкреатического сока в поджелудочную железу. В результате этого растет давление в панкреатических протоках, повреждаются ацинозные клетки поджелудочной железы, что ведет к выходу из этих клеток протеолитических и липолитических ферментов, вызывающих ферментативный некроз и процесс «самопереваривания» панкреатоцитов с последующим возможным присоединением гнойной инфекции. Таким образом, острый панкреатит в не осложненной его форме – процесс асептический, не связанный с какими-либо микробами. Он может начаться и закончиться без присоединения инфекции. Но в некоторых тяжелых осложненных случаях некротизированные ткани поджелудочной железы могут инфицироваться кишечной микрофлорой, что значительно ухудшает состояние больного и оставляет меньше шансов на его выздоровление.
Причинами развития острого панкреатита являются желчнокаменная болезнь, стеноз фатерова сосочка, прием алкоголя и потребление обильной жирной пищи, травма поджелудочной железы и др.
Ведущая роль в патогенезе острого панкреатита принадлежит ферментам поджелудочной железы. Происходит ферментативный аутолиз ткани железы с развитием воспалительной реакции и образованием микротромбов. Прогрессирующее течение острого панкреатита характеризуется панкреатогенной токсемией, гемодинамическими нарушениями, угнетением функции паренхиматозных органов и постнекротическими осложнениями.
Многими поддерживается следующая схема динамики развития тяжелого приступа панкреатита – неделя за неделей.
1-я неделя – воспаление, когда образуется воспалительный инфильтрат, который состоит из поджелудочной железы и окружающих структур (так называемая панкреатическая флегмона);
2-я неделя – некроз, когда в некротический процесс вовлекаются поджелудочная железа и окружающие структуры. Тяжесть состояния при этом зависит от глубины и распространенности некротического процесса, от присоединения вторичной инфекции, от образования в сальниковой сумке так называемых острых перипанкреатических жидкостных скоплений, которые могут рассосаться самостоятельно или трансформироваться в панкреатическую ложную кисту;
3-я неделя – инфицирование, когда микрофлора может проникнуть из близлежащей толстой кишки и вызвать инфицирование некротических масс или ложной кисты;
4-я неделя – исход заболевания, который при благоприятном течении может выразиться в рассасывании неинфицированной некротизированной ткани с выздоровлением больного или в формировании панкреатического абсцесса как результата вторичного инфицирования этой некротизированной ткани поджелудочной железы и окружающих ее структур.
Анамнез Острый панкреатит начинается внезапно, после приема острой, жирной пищи или алкоголя. У большинства больных в анамнезе имеются указания на желчнокаменную болезнь, гастрит, дуоденит, язвенную болезнь или травму живота. Большинство приступов острого отечного панкреатита протекают в слабовыраженной или умеренной форме и разрешаются самостоятельно. Неосложненный приступ острого панкреатита – это, как правило, «болезнь одной недели». Отсутствие тенденции к выздоровлению и сохраняющиеся более 7 дней симптомы воспаления поджелудочной железы могут свидетельствовать о развивающихся осложнениях.
Жалобы на интенсивные, порой очень сильные боли в эпигастрии, опоясывающего характера. Боли иррадиируют в спину, левую и правую лопатку, в область сердца. Наблюдается мучительная многократная рвота с примесью желчи. Рвота не приносит облегчения.
Обследование больного. Особенности клинических проявлений зависят от степени и распространенности морфологических изменений в железе.
При остром отечном панкреатите общее состояние средней тяжести. Больные беспокойны, мечутся в постели, иногда принимают коленно-локтевое положение. Кожные покровы бледные. Нередко наблюдается иктеричность склер и желтуха, обусловленные нарушениями оттока желчи. Температура тела нормальная. Наблюдается умеренная тахикардия. Артериальное давление обычно нормальное. Язык суховат, обложен белым или зеленоватым налетом. Осмотр живота выявляет умеренное вздутие в эпигастральной области, незначительное отставание в акте дыхания. Перкуторно определяется тимпанический звук. При поверхностной пальпации живот мягкий, слегка или умеренно болезненный в эпигастрии (в виде поперечной полосы). Глубокая пальпация выявляет более значительную болезненность в проекции поджелудочной железы. Иногда пальпируется увеличенный и болезненный желчный пузырь. Аускультативно отмечается некоторое ослабление перистальтики кишечника.
Специальные симптомы острого панкреатита:
Симптом Воскресенского — исчезновение пульсации брюшной аорты в эпигастральной области при глубокой пальпации.
Симптом Керте — легкое напряжение брюшных мышц или ригидность их в эпигастрии и болезненность по ходу поджелудочной железы.
Симптом Мейо — Робсона — болезненность при пальпации в реберно-позвоночном углу слева.
Симптомы Ортнера, Мюсси обычно положительны слева.
При панкреонекрозе общее состояние тяжелое. Больные обычно лежат в полусогнутом положении, малоподвижны. При выраженной интоксикации может наблюдаться возбуждение, бред, развитие делириозных психозов. Кожные покровы бледные, выявляется акроцианоз, сосудистые пятна, мраморный рисунок на коже туловища. Температура тела повышена, при гнойно-септических осложнениях она приобретает гектический харак茥ер. Пульс значительно учащен, при тяжелой интоксикации — 120 и более ударов в минуту. Артериальное давление снижено, иногда у больных наблюдается коллапс. Отмечается одышка, наиболее выраженная у больных с тяжелой интоксикацией. Язык сухой, обложен. При осмотре живота определяется значительное его вздутие, причем в основном в эпигастральной области за счет пареза поперечной ободочной кишки, корень брыжейки которой вовлекается в воспалительный процесс. Перкуторно определяют тимпанический звук, иногда в боковых отделах живота — притупление за счет свободной жидкости в брюшной полости (ферментативный перитонит). Поверхностная пальпация выявляет выраженную болезненность и ригидность брюшных мышц в эпигастрии. Глубокая пальпация позволяет обнаружить панкреатогенный инфильтрат в эпигастральной области в проекции поджелудочной железы. Иногда выявляется увеличение печени и желчного пузыря. Аускультативно перистальтика резко ослаблена, при тяжелом перитоните — отсутствует. Симптомы Воскресенского, Керте, Мейо — Робсона, Ортнера, Мюсси положительны.
Кроме того, могут выявляться следующие симптомы, связанные с нарушением проницаемости сосудистой стенки на фоне гиперферментемии, имбибиции подкожной жировой клетчатки эритроцитами и продуктами химических превращений гемоглобина.
Симптом Куллена — желтовато-цианотичная окраска в области пупка.
Симптом Грея — Тернера — цианоз кожи живота.
Симптом Мондора — появление фиолетовых пятен на коже лица и туловища.
При наличии панкреатогенного перитонита появляется симптом Щеткина — Блюмберга.
Диагностика. При легком течении острого панкреатита (отечной его форме) выявляется умеренный лейкоцитоз, сдвиг лейкоформулы влево. Характерно повышение содержания в крови амилазы. При повышении давления в системе желчных путей из-за сдавления их увеличенной головкой поджелудочной железы определяется гипербилирубинемия. В моче наблюдается повышение содержания диастазы свыше 128 ед., уменьшается суточный диурез. Также в моче можно выявить наличие трипсиногена, который в норме не определяется.
При тяжелом течении острого панкреатита (панкреонекрозе) исследование крови выявляет выраженный лейкоцитоз, значительный сдвиглейкоформулы влево, лимфоцитопению. При затяжном течении заболевания, гнойно-септических осложнениях наблюдается анемия. Повышается содержание в крови ферментов поджелудочной железы (амилазы, трипсина, липазы), сахара. Значительное повышение уровня сахара крови можно объяснить обширным некрозом поджелудочной железы, включая островки Лангерганса, поврежденные клетки которых не в состоянии вырабатывать инсулин. При нарушении оттока желчи в двенадцатиперстную кишку увеличивается содержание билирубина в крови. У больных наблюдается олигурия вплоть до анурии при развитии острой почечной недостаточности, появляется трипсиноген и повышается содержание диастазы в моче. Исключением является полное расплавление железы, когда содержание диастазы в моче не только не повышено, но может быть снижено. Кроме того, в моче выявляется наличие сахара, белка, эритроцитов, цилиндров.
Из инструментальных методов исследования при остром панкреатите основным является УЗИ, которое выполняется всем больным с этой патологией. Основными признаками острого панкреатита при этом являются увеличение поджелудочной железы в объеме (переднезадний размер головки поджелудочной железы – более 30 мм), неоднородность ее структуры и нечеткость, размытость ее контуров.
Компьютерная томография – очень информативный метод при остром панкреатите, позволяющий более достоверно судить о состоянии поджелудочной железы, окружающей ее клетчатки и соседних анатомических структур. Метод особенно ценен при тяжелых и осложненных формах заболевания, формировании панкреатогенных инфильтратов и гнойников сальниковой сумки, забрюшинных флегмон.
Лапароскопия при панкреонекрозе позволяет увидеть в брюшной полости характерный геморрагический выпот, при лабораторном исследовании которого находят высокое содержание ферментов поджелудочной железы. О жировом некрозе свидетельствуют характерные «стеариновые бляшки», которые в виде мелких белесых пятен покрывают поверхность анатомических структур брюшной полости, содержащих жир в большом количестве – большой и малый сальник, кишечную брыжейку. Иногда обнаруживается растянутый, увеличенный в размере желчный пузырь – признак желчной гипертензии вследствие сдавления холедоха увеличенной головкой поджелудочной железы.
На обзорной рентгенограмме при панкреонекрозе в левой плевральной полости нередко определяют жидкость в реберно-диафрагмальном синусе (за счет распространения воспаления с поджелудочной железы на диафрагмальную плевру). Экскурсия диафрагмы слева ограничена.
Лечение. Основной метод лечения острого панкреатита – консервативный. Он проводится во всех случаях легкого течения панкреатита (отечный панкреатит) и в большинстве случаев стерильного панкреонекроза. К хирургическому вмешательству приходится прибегать при развитии осложнений – гнойно-септических, аррозионно-геморрагических, механической желтухе, сопутствующем деструктивном холецистите, а также в случае обширных неинфицированных панкреатических и парапанкреатических некрозов, при формировании ложных кист.
1. Консервативное лечение острого панкреатита заключается, прежде всего, в создании «функционального покоя» поджелудочной железе, чтобы свести к минимуму ее экзокринную функцию и тем самым разорвать порочный круг процесса аутолиза железы. С этой целью применяются постельный режим, полный голод, холод на эпигастральную область, назогастральный зонд в случае пареза желудка с аспирацией его содержимого, парентеральное введение октреотида (сандостатина, соматостатина), снижение кислотности желудочного сока (блокаторы «протонной помпы» — омепразол, лосек, или блокаторы Н2-гистаминовых рецепторов – квамател), атропин подкожно.
2. Другим направлением консервативной терапии является ингибиция циркулирующих в крови протеолитических ферментов путем в/в введения контрикала или его аналогов.
3. Очень важным компонентом лечения является сбалансированная инфузионная терапия (в/в введение физиологического раствора хлорида натрия, 5% раствора глюкозы и др.), которая бы восполняла дефицит циркулирующей крови, оказывала дезинтоксикационное действие и улучшала микроциркуляцию.
4. С первого же дня течения тяжелой формы панкреатита (панкреонекроза) показано в/в введение антибиотиков широкого спектра действия с целью профилактики гнойно-септических осложнений. Оптимальным является применение имипенема (тиенама) илиᕻмеронема.
5. Для профилактики синдрома диссеминированного внутрисосудистого свертывания крови показано введение гепарина, лучше в виде низкомолекулярных его форм (клексана, фраксипарина или фрагмина).
6. В случае выраженной и нарастающей интоксикации организма показаны внепочечные способы очищения крови – плазмаферез, гемосорбция и др.
Хирургическое лечение тяжелых форм острого панкреатита – будь то инфицированный или неинфицированный панкреонекроз – заключается в удалении некротизированных тканей. Основные цели при операции:
· эвакуировать некротические и инфицированные субстраты,
· дренировать токсические продукты, гной,
· предотвратить дальнейшее накопление этих продуктов,
· избежать повреждения соседних органов и сосудов.
В настоящее время используется 3 оперативных подхода в зависимости от распространенности инфицированного панкреонекроза и тяжести заболевания:
1. Очищение, широкое дренирование и закрытие живота. Дальнейшие вмешательства выполняются «по необходимости»,
2. Локальная ирригация сальниковой сумки через дренажные трубки в течение нескольких недель, с последующей повторной операцией «по необходимости»,
3. Метод лапаростомии, когда живот оставляют открытым, и планируют релапаротомии для повторного очищения от некротизированных тканей.
Если до или во время операции выявляется желчная гипертензия с механической желтухой, вызванная сдавлением увеличенной отечной головкой поджелудочной железы общего желчного протока, появляются показания для наложения декомпрессионной холецистостомы.
Дата добавления: 2015-04-01; просмотров: 4803; Опубликованный материал нарушает авторские права? | Защита персональных данных | ЗАКАЗАТЬ РАБОТУ
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Только сон приблежает студента к концу лекции. А чужой храп его отдаляет. 8952 — | 7621 — или читать все…
Читайте также:
Источник


