При остром панкреатите происходит внутриклеточная активация трипсиногена
Лабораторная работа. ОПРЕДЕЛЕНИЕ АМИЛАЗНОЙ АКТИВНОСТИ МОЧИ
Под амилазной активностью мочи понимают количество субстрата (крахмала), расщепляемого I мл мочи за определенный промежуток времени (например, 15 мин.) при 450. Подразумевается, что в моче в качестве патологического компонента содержится фермент амилаза, попадающий в кровь при заболеваниях поджелудочной железы.
Принцип метода: Определение основано на нахождении максимального разведения мочи, при котором амилаза мочи еще расщепляет крахмал, т.е. в пробирке нет синего оттенка при добавление йода (образовавшиеся декстрины дадут красно — бурый цвет, желтый цвет, свидетельствующий об отсутствии крахмала). Учитывая разведение, следует рассчитывать количество крахмала, которое гидролизует 1 мл неразведенной мочи.
Ход определения: Берут 10 пронумерованных пробирок, наливают в каждую по 1 мл физиологического (0,85%) раствора хлористого натрия. Затем в 1-ую пробирку приливают 1 мл исследуемой мочи, перемешивают и промывают пипетку 5-6 кратным набором раствора из пробирки, далее 1 мл смеси переносят во 2 пробирку, перемешивают и вновь промывают пипетку и т.д. Таким образом получают разведение мочи в 2, 4, 8, 16 (и далее в геометрической прогрессии) раз.
В каждую пробирку наливают по 1 мл физиологического раствора (активатор амилазы мочи, очень слабый по своей активности) и по 2 мл 0,1% крахмала, тщательно перемешивают и все пробирки ставят на 15 минут в термостат при температуре 450. После инкубации пробирки охлаждают, добавляют по 2 капли раствора йода. Для расчета берут пробирку с наибольшим разведением мочи, где нет синего оттенка, т.е. пробирку, где произошло расщепление крахмала.
Расчет разберем на конкретном примере:
1. допустим, что
расщепление крахмала произошло в 4 пробирке, где моча разведена в 16 раз, т.е
2 мл 1/16 мл мочи расщепляет ——-2 мл 0,1% раствора крахмала
1 мл мочи ————————- —-Х мл 0,1% раствора крахмала,
отсюда:
Х = 2 х 16 =32 мл
Результат записывается так: d 450/15 = 32ед., где d — диастаза мочи (амилаза). В норме она равна 16 — 64 ед. Количество амилазы в моче повышается при панкреатите, заболевании желчных путей и т.д. При почечной недостаточности амилаза в моче отсутствует.
Результат:
Вывод:
Задачи для решения студентами:
1. При остром панкреатите происходит внутриклеточная активация трипсиногена и химотрипсиногена, в результате чего происходит разрушение тканей поджелудочной железы. Такие лечебные препараты как трасилол, контрикал, гордокс являются структурными аналогами субстратов этих ферментов. На чем основано лечебное действие этих препаратов?
Примерный ответ: так как указанные препараты являются структурными аналогами субстратов, то их применяют в качестве конкурентных ингибиторов
2.Больной с переломом костей голени поступил в травматологическое отделение больницы. Определение активности какого фермента следует провести?
Примерный ответ: при переломе кости (деструкция ткани) происходит поступление в кровь внутриклеточных ферментов, в частности щелочной фосфатазы, которая является маркером при переломах костей.
3.На клинической консультации обсуждаются анализы мочи больного панкреатитом и больного с опухолью почек. У первого больного в моче обнаружена амилаза, а у второго – трансаминаза. Почему нарастание амилазы мочи может указывать на внепочечный характер заболевания (панкреатит), а подъем на поражение почек (рак)?
Примерный ответ: появление в крови внутриклеточного фермента панкреатической железы — амилазы свидетельствует о панкреатите, тогда как трансаминазы являются маркерами на поражение различных внутренних органов (печени, сердца, почек)
4.Гомогенат печени кролика содержит фермент сукцинатдегидрогеназу (СДГ); его инкубировали с субстратом (янтарной кислотой) в присутствии малоновой кислоты. Изменится ли активность СДГ? Каким образом:
а) при увеличении концентрации малоновой кислоты;
б) при увеличении концентрации янтарной кислоты?
Примерный ответ: а) малоновая кислота является структурным аналогом сукцината, будет ингибировать реакцию СДГ по механизму конкурентного ингибирования
Б) увеличение концентрации янтарной кислоты вытеснит из активного центра фермента ингибитор и активность СДГ повысится ( при ответе предлагается студенту написать реакцию, катализируемую СДГ, а также структуру малоната).
5. Каков механизм действия сульфаниламидных препаратов, ингибирующих рост патогенных бактерий, нуждающихся в парааминобензойной кислоте?
Примерный ответ: механизм конкурентного ингибирования (при ответе предлагается студенту написать структуру ПАБК и сульфаниламида)
Дайте ответы на следующие вопросы:
1. Назовите ферменты, которые используются в клинике в лечебных целях. Укажите, при каких патологических состояниях используются такие ферменты как пепсин, гиалуронидаза, нуклеазы. Каковы причины применения ферментов с лечебной целью?
Примерный ответ: пепсин применяют при недостаточной секреции этого фермента слизистой желудка, гиалуронидазу – при заболеваниях, сопровождающих рост соединительной ткани — для рассасывания послеоперационных рубцов, рубцов после термических ожогов, артритах, гематомах, так как гиалуронидаза способствует разрушению соединительной ткани; нуклеазы применяют для лечения хронических гнойных и воспалительных процессов, они снижают вязкость гнойного содержимого, обладаеют противовоспалительным действием, при конъюнктивитах и др.
2. Приведите примеры, демонстрирующие диагностическое значение определения активности ферментов (трансаминаз, альфа — амилаза, кислой и щелочной фосфатаз, изоферментов ЛДГ) в крови.
Примерный ответ: трансаминазы определяют при инфрктах (АСТ) и гепатитах (АЛТ), амилазу – при панкреатитах, кислую фосфатазу при простатитах, щелочную при повреждениях костной ткани, так как они являются органоспецифичными.
Дата добавления: 2015-04-30; просмотров: 2210; Опубликованный материал нарушает авторские права? | Защита персональных данных | ЗАКАЗАТЬ РАБОТУ
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9588 — | 7378 — или читать все…
Читайте также:
Источник
ТЕМА:
Механизм
действия ферментов. Виды регуляции
ферментативной активности
ЦЕЛИ
ЗАНЯТИЯ: Изучить механизм действия
ферментов, а также механизмы, лежащие
в основе действия активаторов и
ингибиторов на активность ферментов.
Необходимый
исходный уровень
Из
курса биоорганической химии студенты
должны знать:
—
теорию катализа;
—
кинетику ферментативных реакций.
Учебная карта занятия Вопросы для подготовки к занятию
Механизм
действия ферментов. Зависимость скорости
ферментативной реакции от концентрации
субстрата и фермента.Изостерические
активаторы и ингибиторы ферментов:
химическая природа, виды активирования
и ингибирования ферментов. Биологическое
и медицинское значение активаторов и
ингибиторов ферментов.Номенклатура
и классификация ферментов.Принципы
количественного определения активности
ферментов. Единицы активности.Определение
активности ферментов в диагностике
заболеваний.Применение
ферментов как лекарственных препаратов.
Представление об энзимотерапии и
энзимодиагностики.Понятие
о сигнальных ферментахЛактатдегирогеназа,
характеристика изоферментов, свойства,
особенности строения и локализации,
клинико-диагностическое значение
определения при заболеваниях сердца,
печени и др.Трансаминазы,
виды, характеристика, локализация,
клинико-диагностическое значение
определения трансаминазЗначение
определения ферментов с целью прогноза
и лечения.Заместительные
ферменты.
Практическая часть занятия
Лабораторная
работа. ОПРЕДЕЛЕНИЕ
АМИЛАЗНОЙ АКТИВНОСТИ МОЧИ
Под
амилазной активностью мочи понимают
количество субстрата (крахмала),
расщепляемого I мл мочи за определенный
промежуток времени (например, 15 мин.)
при 450.
Подразумевается, что в моче в качестве
патологического компонента содержится
фермент амилаза, попадающий в кровь при
заболеваниях поджелудочной железы.
Принцип
метода: Определение
основано на нахождении максимального
разведения мочи, при котором амилаза
мочи еще расщепляет крахмал, т.е. в
пробирке нет синего оттенка при добавление
йода (образовавшиеся декстрины дадут
красно — бурый цвет, желтый цвет,
свидетельствующий об отсутствии
крахмала). Учитывая разведение, следует
рассчитывать количество крахмала,
которое гидролизует 1 мл неразведенной
мочи.
Ход
определения:
Берут 10 пронумерованных пробирок,
наливают в каждую по 1 мл физиологического
(0,85%) раствора хлористого натрия. Затем
в 1-ую пробирку приливают 1 мл исследуемой
мочи, перемешивают и промывают пипетку
5-6 кратным набором раствора из пробирки,
далее 1 мл смеси переносят во 2 пробирку,
перемешивают и вновь промывают пипетку
и т.д. Таким образом получают разведение
мочи в 2, 4, 8, 16 (и далее в геометрической
прогрессии) раз.
В
каждую пробирку наливают по 1 мл
физиологического раствора (активатор
амилазы мочи, очень слабый по своей
активности) и по 2 мл 0,1% крахмала, тщательно
перемешивают и все пробирки ставят на
15 минут в термостат при температуре
450.
После инкубации пробирки охлаждают,
добавляют по 2 капли раствора йода. Для
расчета берут пробирку с наибольшим
разведением мочи, где нет синего оттенка,
т.е. пробирку, где произошло расщепление
крахмала.
Расчет
разберем на конкретном примере:
допустим,
что
расщепление
крахмала произошло в 4 пробирке, где
моча разведена в 16 раз, т.е
2
мл 1/16 мл мочи расщепляет ——-2 мл 0,1%
раствора крахмала
1
мл мочи ————————- —-Х мл 0,1%
раствора крахмала,
отсюда:
Х
= 2 х 16 =32 мл
Результат
записывается так: d 450/15
= 32ед., где d — диастаза мочи (амилаза). В
норме она равна 16 — 64 ед. Количество
амилазы в моче повышается при панкреатите,
заболевании желчных путей и т.д. При
почечной недостаточности амилаза в
моче отсутствует.
Результат:
Вывод:
Задачи
для решения студентами на дом
1.
При остром панкреатите происходит
внутриклеточная активация трипсиногена
и химотрипсиногена, в результате чего
происходит разрушение тканей поджелудочной
железы. Такие лечебные препараты как
трасилол, контрикал, гордокс являются
структурными аналогами субстратов этих
ферментов. На чем основано лечебное
действие этих препаратов?
Примерный
ответ:
так как указанные препараты являются
структурными аналогами субстратов, то
их применяют в качестве конкурентных
ингибиторов
2.Больной
с переломом костей голени поступил в
травматологическое отделение больницы.
Определение активности какого фермента
следует провести?
Примерный
ответ:
при переломе кости (деструкция ткани)
происходит поступление в кровь
внутриклеточных ферментов, в частности
щелочной фосфатазы, которая является
маркером при переломах костей.
3.На
клинической консультации обсуждаются
анализы мочи больного панкреатитом и
больного с опухолью почек. У первого
больного в моче обнаружена амилаза, а
у второго – трансаминаза. Почему
нарастание амилазы мочи может указывать
на внепочечный характер заболевания
(панкреатит), а подъем на поражение почек
(рак)?
Примерный
ответ:
появление в крови внутриклеточного
фермента панкреатической железы —
амилазы свидетельствует о панкреатите,
тогда как трансаминазы являются
маркерами на поражение различных
внутренних органов (печени, сердца,
почек)
4.Гомогенат
печени кролика содержит фермент
сукцинатдегидрогеназу (СДГ); его
инкубировали с субстратом (янтарной
кислотой) в присутствии малоновой
кислоты. Изменится ли активность СДГ?
Каким образом:
а)
при увеличении концентрации малоновой
кислоты;
б)
при увеличении концентрации янтарной
кислоты?
Примерный
ответ: а)
малоновая кислота является структурным
аналогом сукцината, будет ингибировать
реакцию СДГ по механизму конкурентного
ингибирования
Б)
увеличение концентрации янтарной
кислоты вытеснит из активного центра
фермента ингибитор и активность СДГ
повысится ( при ответе предлагается
студенту написать реакцию, катализируемую
СДГ, а также структуру малоната).
5.
Каков механизм действия сульфаниламидных
препаратов, ингибирующих рост патогенных
бактерий, нуждающихся в парааминобензойной
кислоте?
Примерный
ответ: механизм
конкурентного ингибирования (при ответе
предлагается студенту написать структуру
ПАБК и сульфаниламида)
Дайте
ответы на следующие вопросы:
Назовите
ферменты, которые используются в клинике
в лечебных целях. Укажите, при каких
патологических состояниях используются
такие ферменты как пепсин, гиалуронидаза,
нуклеазы. Каковы причины применения
ферментов с лечебной целью?
Примерный
ответ: пепсин
применяют при недостаточной секреции
этого фермента слизистой желудка,
гиалуронидазу – при заболеваниях,
сопровождающих рост соединительной
ткани — для рассасывания послеоперационных
рубцов, рубцов после термических ожогов,
артритах, гематомах, так как гиалуронидаза
способствует разрушению соединительной
ткани; нуклеазы применяют для лечения
хронических гнойных и воспалительных
процессов, они снижают вязкость гнойного
содержимого, обладаеют противовоспалительным
действием, при конъюнктивитах и др.
2.
Приведите
примеры, демонстрирующие диагностическое
значение определения активности
ферментов (трансаминаз, альфа — амилаза,
кислой и щелочной фосфатаз, изоферментов
ЛДГ) в крови.
Примерный
ответ: трансаминазы определяют при
инфрктах (АСТ) и гепатитах (АЛТ), амилазу
– при панкреатитах, кислую фосфатазу
при простатитах, щелочную при повреждениях
костной ткани, так как они являются
органоспецифичными.
Практические
навыки, которыми должен овладеть студент
по теме занятия
Должен
освоить методы количественного
определения ферментов в биологических
жидкостях, уметь интерпретировать
лабораторные данные.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
г) субстратным
9.Торможение ферментативной реакции, вызванное связыванием с активным центром фермента ингибитора, сходного по структуре с субстратом, называют … ингибированием
а) конкурентным б) неконкурентным
в) бесконкурентным г) субстратным
10.Перенос остатка фосфорной кислоты в пределах молекулы субстрата осуществляет …
а) дегидрогеназа б) оксигеназа в) мутаза г) синтетаза
11.К классу гидролаз относятся ферменты, катализирующие реакции
…
а) переноса групп от одного субстрата к другому б) разрыва связей в субстрате с присоединением воды и образо-
ванием двух продуктов реакции в) окисления-восстановления
г) синтеза веществ без использования энергии АТФ
12.К классу лиаз относятся ферменты, катализирующие реакции …
а) переноса групп от одного субстрата к другому б) разрыва связей в субстрате без присоединения воды и окис-
ления в) окисления-восстановления
г) синтеза веществ с использованием энергии АТФ
13.Включение кислорода в молекулу субстрата осуществляет … а) дегидрогеназа б) оксигеназа в) мутаза г) фосфатаза
14.Оптимум рН для пепсина 1,5-2,5. Для восстановления нарушенной активности эндогенного пепсина необходимо принимать …
а) разбавленный раствор соляной кислоты б) глицин в) глюконат кальция
г) изонитрозин
15.Ферментный препарат фестал применяется при …
51
а) секреторной недостаточности желудка и поджелудочной железы
б) свежем инфаркте миокарда в) образовании грубых рубцов г) тромбоэмболии
III. Контрольные задания для самостоятельной работы:
А. Решите следующие ситуационные задачи:
1.Фермент карбоксипептидаза (панкреатического сока) представлен полипептидной цепью из 307 аминокислотных остатков. В активном центре фермента функциональные группы аргинина, тирозина, глутамата (положение в полипептидной цепи — 270, 248, 145 соответственно) катализируют гидролиз пептидной связи, образованной С – концевой аминокислотой. Объясните, каким образом эти три аминокислоты, расположенные так далеко друг от друга в полипептидной цепи, могут превращать субстрат?
2.Оптимальные условия действия α–амилазы, фермента гидролизующего крахмал: рН = 6,8; t =37С0. Как изменится активность фермента в каждом конкретном случае (уменьшится; увеличится)
А) рН инкубационной среды равен 5;
Б) t инкубации-70С
3.Больной был госпитализирован с острыми болями в области сердца. Определение активности какого фермента в крови поможет диагностировать инфаркт миокарда в первые часы заболевания?
4.Обсудите проблему «Органоспецифические ферменты и изменение их активности при патологических состояниях». Для этого вначале дайте определение органоспецифическим ферментам и приведите примеры. Далее назовите ферменты, активность которых изменяется при повреждении мышечных органов, печени, поджелудочной железы.
5.При биохимическом исследовании крови выявлено увеличение активности щелочной фосфатазы. Какие возможные причины увеличения активности фермента?
6.Как изменится общая активность ЛДГ и ее изоферментный спектр у больного с болезнью Боткина (вирусный гепатит)?
7.При остром панкреатите происходит внутриклеточная активация трипсиногена и химотрипсиногена, в результате чего происходит разрушение тканей поджелудочной железы. Такие лечебные препараты как трасилол, контрикал, гордокс являются структурными
52
аналогами субстратов этих ферментов. На чем основано лечебное действие этих препаратов?
Б. Изобразите графически зависимость активности фермента от температуры, реакции среды.
В. Приведите примеры простых и сложных ферментов.
Частный модуль 1.3. Введение в обмен веществ и энергии.
После изучения частного модуля 1.3. студент должен:
Знать: строение, роль клеточных мембран и их транспортных систем в обмене веществ в организме человека. Основные этапы переваривания и всасывания белков, углеводов, липидов в ЖКТ, регуляцию и возможные нарушения на различных этапах изучаемых процессов.
Уметь: оценивать информативность определения компонентов желудочного сока в норме и при патологических состояниях; самостоятельно находить достаточное количество информации для решения ситуационных задач.
Владеть: навыками работы с информацией: учебной, научной, нор- мативно-справочной литературой; способностью проводить химический эксперимент и интерпретировать его результаты.
Биологические мембраны: структурная организация, функции и свойства биологических мембран.
Все клетки имеют мембраны. Основу мембраны составляет двойной липидный слой, который формируют фосфолипиды и гликолипиды. Липидный бислой образован двумя рядами липидов, гидрофобные радикалы которых спрятаны внутрь, а гидрофильные группы обращены наружу и контактируют с водной средой. Основная роль липидов в составе мембран заключается в стабилизации бислоя. Другой важный компонент мембран – белки различаются по своему положению в мембране. Они могут глубоко проникать в липидный бислой или даже пронизывать его – интегральные белки, либо разными способами прикрепляться к мембране – поверхностные белки. Белки мембран отвечают за функциональную активность мембран.
К основным функциям мембран можно отнести:
1.Отделение клетки от окружающей среды и формирование внутриклеточных пространств (отсеков).
2.Преобразование энергии пищевых органических веществ в энергию химических связей молекул АТФ.
3.Участие в обеспечении межклеточных взаимодействий, передаче
53
внутрь клетки сигналов.
4. Контроль и регулирование транспорта веществ через мембраны.
Общие представления о транспорте веществ.
Транспорт веществ возможен с помощью следующих механизмов:
1.Механический транспорт осуществляется в результате движения жидкости, создаваемого механической работой сердца или других органов.
2.Диффузионный транспорт происходит под действием осмотических сил. Диффузия бывает двух типов – обычная (пассивный транспорт) и облегченная. Путем обычной диффузии через липидную мембрану проходят малые неполярные молекулы. Облегченная диффузия отличается от обычной только тем, что происходит с подвижным переносчиком, облегчающим прохождение вещества по градиенту концентрации.
3.При активном транспорте перенос веществ против градиента концентрации осуществляется с помощью белков-переносчиков и протекает с затратой энергии.
4.Электрофоретический транспорт – это транспорт заряженных частиц в электрическом поле. Движущей силой транспорта служит знак заряда и значение электрического потенциала.
5.Везикулярный транспорт обеспечивает перенос крупных молекул и частиц (белков, чужеродных тел и др.) через клеточную мембрану. Различают два вида транспорта: пиноцитоз, когда вещества втягиваются из внешней среды внутрь клетки и экзоцитоз, когда макромолекулы поступают из клетки во внешнюю среду.
Основные компоненты пищи и их значение. Биохимические основы сбалансированного питания.
Питание обеспечивает рост, развитие и активную деятельность человека. К питательным веществам относятся 6 групп веществ:
1)Белки. Суточная потребность в них взрослого человека составляет 80-100 грамм. Если белки содержат все незаменимые аминокислоты, то они относятся к полноценным, остальные пищевые белки — неполноценные.
2)Углеводы. Суточная потребность составляет 400-500 грамм, из них около 400 грамм приходится на крахмал, остальная часть — на дисахариды (в основном сахарозу) и небольшое количество – на моно-
54
сахариды (глюкоза, фруктоза). Основная функция углеводов — энергетическая.
3)Липиды. Суточная потребность в пищевых липидах 80-100 грамм, из них не менее 30% растительных жиров, содержащих ненасыщенные жирные кислоты (линолевую, линоленовую, арахидоновую). Жиры животного происхождения богаты насыщенными жирными кислотами: масляной, пальмитиновой. Чем больше насыщенных жирных кислот, тем жиры труднее расщепляются в организме.
4)Витамины. Витамины представляют собой органические пищевые вещества, которые требуются для нормального метаболизма в малых дозах и не могут синтезироваться организмом в достаточном количестве. Суточная потребность индивидуальна для каждого витамина и выражается в мкг-мг. Выполняют специфические биохимические функции в организме.
5)Вода. Суточная потребность — 1750-2200 грамм. Почти все биохимические процессы в клетке протекают в водной среде.
6)Минеральные вещества. Важнейшие неорганические компоненты питания человека подразделяются на 3 группы:
-макроэлементы(Fe, Mg, K,Ca,Na,P) их потребность 1-3 грамма
-микроэлементы(I,F,Mn,Al,Br,Zn,Ni,Co,Si) 5-6 мг
-ультраэлементы(Hg,Ar,Pb) до 1 мг
Питательные вещества проходят следующие этапы метаболизма: пищеварение, всасывание (транспорт через стенки кишечника), транспорт от кишечника к другим органам и тканям, проникновение внутрь клетки (транспорт через клеточную мембрану) и превращение ферментативными системами клеток.
Пищеварение является ферментативным процессом и происходит в трех отделах пищеварительного тракта: ротовой полости, желудке и тонком кишечнике.
Переваривание белков в пищеварительном тракте. Характеристика протеолитических ферментов, механизм активации и условия действия. Всасывание продуктов переваривания белка.
Белки поступают в ротовую полость, там они смачиваются слюной, перемешиваются и поступают в желудок. В желудке начинается переваривание белков под действием ферментов: пепсина и гастриксина. У детей грудного возраста в желудке находится фермент реннин, вызывающий свертывание молока.
Пепсин вырабатывается в главных клетках слизистой желудка в виде неактивного фермента – пепсиногена. Активируется пепсиноген
55
с помощью HCl и аутокаталитически, то есть с помощью образующихся молекул пепсина. Оптимум действия пепсина pH=1,5-2,5.
Пепсин расщепляет внутренние пептидные связи, образованные карбоксильными группами ароматических аминокислот — фенилаланина, тирозина и триптофана.
Гастриксин близок к пепсину по молекулярной массе. Оптимум pH для него 3-3,5. Гастриксин действует на пептидные связи, образованные дикарбоновыми аминокислотами.
Пепсин и гастриксин гидролизуют белки до смеси полипептидов (альбумоз и пептонов).
Роль HCl процессе пищеварения
1.Активирует пепсиноген
2.Создает оптимум pH в желудочном соке для действия пепсина и гастриксина
3.Антимикробное действие
4.Денатурация пищевых белков
5.Активирует выработку гастрина и гистамина
Желудочное содержимое, или химус, в ходе переваривания поступает в двенадцатиперстную кишку, куда открываются панкреатический и желчный протоки. Щелочное содержимое секрета поджелудочной железы нейтрализует химус и сдвигает его рН в щелочную сторону. Этот сдвиг рН необходим для проявления активности ферментов панкреатического и кишечного сока и ингибирует дальнейшее действие пепсина. В панкреатическом соке содержатся протеолитические ферменты — трипсин, химотрипсин и эластаза. Эти ферменты расщепляют белки и полипептиды, поступающие из желудка. Трипсин действует на пептидные связи, образуемые основными аминокислотами (лизином, аргинином), химотрипсин — на связи между остатками незаряженных аминокислот (например, ароматических). Эластаза воздействует на пептидные связи, образованные аминокислотами: глицином, аланином, серином, а также пролином. Все три фермента секретируются в виде проферментов. Активация трипсиногена осуществляется энтерокиназой (протеолитическим ферментом, вырабатываемой слизистой кишечника) и аутокаталитически. Остальные проферменты активируется при помощи образовавшегося трипсина. Карбоксипептидаза А отщепляет С — концевые алифатические и ароматические аминокислоты, а карбоксипептидаза В – только концевые остатки лизина и аргинина. N-концевые аминокислоты отщепляют аминополипептидазы кишечника.
56
Разнообразие протеолитических ферментов приводит к полному расщеплению белков до свободных аминокислот, которые затем всасываются в кишечнике активным путем, т.е. с затратой энергии АТФ, с участием ионов Nа+ и специфических переносчиков белковой природы. Всосавшиеся аминокислоты в последствие могут использоваться:
1.На синтез специфических белков клетки.
2.На синтез биологически активных соединений (медиаторы, гормоны и др.)
3.Окисляться до СО2 и Н2О.
Переваривание липидов в ЖКТ. Гидролиз триацилглицеридов и фосфолипидов, всасывание конечных продуктов гидролиза.
Переваривание липидов у взрослого человека происходит в кишечнике, где имеются все необходимые для этого условия:
В кишечнике нейтрализуется поступающая из желудка пища, а жир подвергается эмульгированию (смешиванию жира с водой). Эмульгирование липидов протекает под действием желчных кислот, поступающих в кишечник в составе желчи. Желчные кислоты выполняют следующие биологические функции:
1)эмульгирующую
2)функцию активатора липолитических ферментов
3)транспортную: желчные кислоты образуют комплекс с высшими жирными кислотами и помогают их всасыванию в кишечнике.
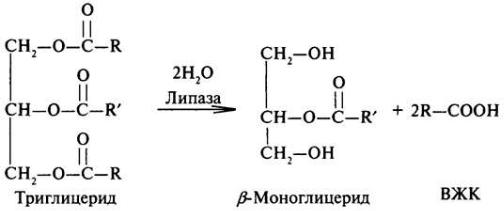
Основную часть пищевых липидов составляют триацилглицерины (ТАГ). Их гидролиз происходит под действием панкреатической липазы. Липаза поступает в неактивном виде. Она активируется в кишечнике желчными кислотами и специальным фактором — колипазой. Активная липаза действует на триацилглицерины жировой капли. Продуктами гидролиза являются чаще всего 2-моноацилглицерин и свободные жирные кислоты.
57
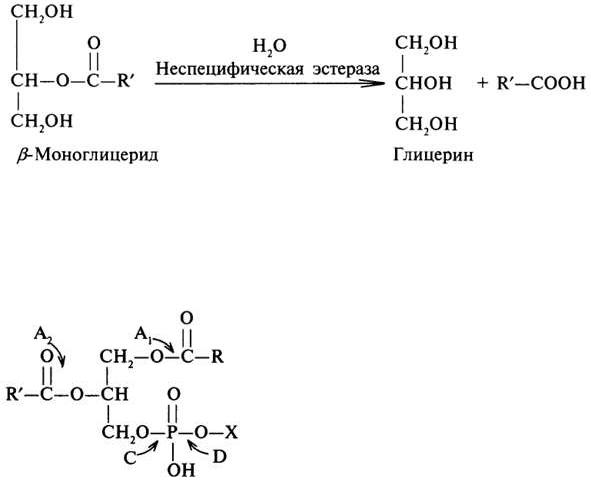
β-Моноглицерид, образовавшийся на первом этапе распада триглицеридов, далее гидролизуется неспецифической эстеразой до глицерина и высшей жирной кислоты:
Гидролиз другой группы липидов — фосфолипидов осуществляется фосфолипазами. Существует несколько типов фосфолипаз, обозначаемые как А1,А2, С ,D, они гидролизуют разные связи в молекуле фосфолипида
Конечными продуктами их гидролиза является глицерин, жирные кислоты, неорганический фосфат и один из остаточных спиртов (холин, этаноламин, инозит, серин).
Фосфолипазы вырабатываются в поджелудочной железе и кишечнике в неактивном виде. Для активизации этих ферментов требу-
ется отщепление ингибирующего пептида, а также желчные кислоты и ионы Са2+.
Продукты гидролиза всех пищевых липидов всасываются в кишечнике. Короткоцепочечные жирные кислоты (до 10-12 углеродных атомов) транспортируются простой диффузией внутрь кишечного эпителия. Длинноцепочечные жирные кислоты (более 14 углеродных атомов) образуют транспортные комплексы с желчными кислотами. Частично липиды всасываются в виде триацилглицеринов (3-6%) путем пиноцитоза, значительная часть (до 50%) в виде 2- моноацилглицеринов; легко всасываются глицерин, фосфаты, холин и другие спирты, сфингозин и холестерин.
58
Продукты переваривания липидов далее поступают в кровь и лимфу. Однако, прежде чем поступить в лимфу, в кишечной стенке некоторые липиды подвергаются ресинтезу. В эпителии кишечника наблюдается ресинтез триглицеринов, фосфолипидов и эфиров холестерина.
Биологическая роль ресинтеза липидов состоит в том, что в стенке кишечника образуются липиды, более свойственные организму человека, а не пищевому жиру, который может резко отличаться по фи- зико-химическим показателям от липидов человека.
Липиды в водной среде (а значит и в крови) нерастворимы, поэтому для транспорта липидов в организме образуются комплексы липидов с белками – липопротеины (смотри сложные белки).
Переваривание углеводов в пищеварительном тракте. Характеристика амилолитических ферментов. Всасывание конечных продуктов гидролиза углеводов.
Углеводы человек получает с пищей в основном в виде полисахаридов (растительного крахмала, клетчатки (целлюлозы), гликогена), в меньших количествах в виде дисахаридов, и совсем немного — моносахаридов. Переваривание углеводов начинается в ротовой полости с помощью — амилазы слюны. –амилаза активна при рН 7,1, она действует на внутренние — 1,4 – гликозидные связи крахмала, образуя полисахариды меньшей молекулярной массы – декстрины, а также мальтозу и небольшое количество глюкозы. В желудке — амилаза инактивируется кислым содержимым желудка и переваривание углеводов прекращается.
Переваривание углеводов возобновляется в тонком кишечнике под действием ферментов поджелудочной кислоты и кишечника. Поступающий туда кислый химус нейтрализуется бикарбонатами, создавая слабощелочную среду, оптимальную для действия панкреатической-амилазы. Панкреатическая -амилаза завершает расщепление полисахаридов и олигосахаридов до дисахарида мальтозы. Гидролиз-1,6- гликозидных связей в точках вставления полисахарида осу-
ществляет олиго 1,6 – глюкозидаза.
Дальнейшее переваривание мальтозы и дисахаридов осуществляется в области щеточной каемки эпителиальных клеток (энтероцитов) тонкого кишечника. Дисахаридазы являются интегральными белками микроворсинок энтероцита. Они образуют полиферментный комплекс, состоящий из четырех ферментов, активные центры которых направлены в просвет кишечника: 1) мальтаза гидролизует мальтозу
59
на 2 молекулы глюкозы; 2) изомальтаза имеет два активных центра и может осуществлять гидролиз изомальтозы до двух молекул глюкозы и сахарозы до фруктозы и глюкозы; 3) лактаза гидролизует лактозу на галактозу и глюкозу; 4) трегалаза катализирует гидролиз дисахарида — трегалозы, содержащегося в грибах.
Конечными продуктами переваривания углеводов являются моносахариды, преимущественно глюкоза, фруктоза, галактоза. Далее в тонком кишечнике происходит всасывание моносахаридов посредством вторичного активного транспорта с участием ионов Nа+ и специального переносчика.
Наиболее быстро всасывается галактоза, затем глюкоза. Всосавшиеся моносахариды поступают из кишечной стенки в портальную вену, в печень и разносятся кровью к остальным тканям.
Транспортные липопротеиды крови, особенности строения, состава и функции разных липопротеидов. Роль в обмене жиров и холестерина. Пределы изменений концентрации жиров и холестерина в крови. Липопротеинемии.
Смотри раздел: «Сложные белки»
I.Вопросы для самоподготовки:
1.Расскажите о структурной организации биологических мембран.
2.Назовите основные биологические функции мембран.
3.Перечислите и дайте краткую характеристику основным видам транспорта веществ.
4.Расскажите об основных компонентах пищи их значении.
5.Механизм переваривания белков в пищеварительном тракте.
6.Дайте характеристику основным протеолитическим ферментам, расскажите о механизме их активации и условиях действия.
7.Всасывание продуктов гидролиза белков.
8.Переваривание нуклеопротеинов и всасывание продуктов гидролиза.
9.Гидролиз триацилглицеринов и фосфолипидов.
10.Назовите биологическая роль ресинтеза липидов.
11.Механизм переваривания углеводов в пищеварительном тракте.
12.Характеристика амилолитических ферментов.
13.Всасывание продуктов гидролиза углеводов.
II.Тестовые вопросы для самоконтроля:
1.В образовании двойного липидного слоя мембраны не принимают участие…
60
Источник


