Препараты при хроническом панкреатите с гиперамилаземией
Медицина / Диагностика / Диагностика (статья)
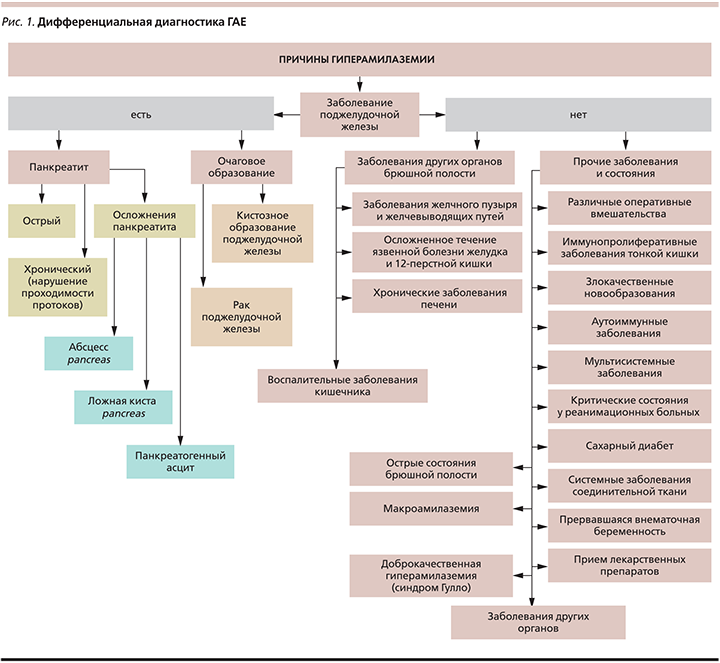
Причины гиперамилаземии
|
11-08-2018, 13:58
|
 ПанкреатитПАНКРЕАТИТ
ПанкреатитПАНКРЕАТИТ
Острый панкреатит
Острый панкреатит считается относительно распространенной патологией. Например, в Великобритании это заболевание поражает 22 человека в расчете на 100000 граждан в год. Статистика показывает, что за последние 20 лет рост заболеваемости составляет примерно 3% в год. Наибольший рост заболеваемости острым панкреатитом отмечается среди взрослого населения: среди женщин моложе 35 лет рост заболеваемости составляет в среднем 11% в год, среди мужчин от 35 до 45 лет – 5,6% в год).
Наиболее распространенные причины развития острого панкреатита – желчнокаменная болезнь и алкоголизм, — на долю которых припадает около 80% случаев. Также к многочисленным причинам развития острого панкреатита относят: стресс, отравление химическими веществами, повреждения поджелудочной железы, вирусные заболевания (цитомегаловирус, вирус Эпштейн-Барр, эпидемический паротит и др), гиперпаратиреоз (гиперактивность паращитовидных желез), высокий уровень липидов в крови, глистные инвазии (гельминтозы) и др. В редких случаях острый панкреатит развивается как осложнение после хирургического вмешательства в органы верхней части брюшной полости. Так же редко причиной возникновения патологии может быть прием лекарственных препаратов (стероиды, тиазидные диуретики, ингибиторы ангиотензинпревращающего фермента (АПФ) и др). Некоторые специалисты описывали очень редкие случаи развития острого панкреатита после эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ – инвазивная диагностическая процедура).
Острый панкреатит – острое воспалительное заболевание, возникающее из-за преждевременной активации ферментов, расщепляющих белки (протеолитических ферментов). Активация протеолитических ферментов в тканях поджелудочной железы вызывает процесс аутопереваривания (то есть, самопереваривание поджелудочной железы). До сих пор не известно, каким образом, например, камни в желчном пузыре или алкоголь вызывают этот процесс. Вероятно, что на это влияет временное затруднение движения панкреатического сока по причине обструкции желчными камнями, которые попали в фатеровую ампулу (месте выхода желчного и вирсунгова (панкреатического) протока в двенадцатиперстную кишку).
Главный симптом острого панкреатита – резкое возникновение острой боли в верхней части живота, которая часто распространяется (иррадиирует) в область спины, часто сопровождающаяся повышением температуры тела (гипертермией) и рвотой. Патология имеет вариабельный характер течения. Часто воспалительный процесс разрешается в течение небольшого промежутка времени (от нескольких суток до одной недели) без каких-либо последствий. Однако в 20-25% случаев острый панкреатит сопровождается очень тяжелым, угрожающим жизни течением, так как локальное воспаление приобретает системный характер (синдром системного воспалительного ответа) с высоким развитием множественной органной недостаточности и сепсиса.
К распространенным осложнениям острого панкреатита относится суперинфекция (вызванная обширным некрозом тканей, причем не только поджелудочной железы), анемия, геморрагии, диссеминированное внутрисосудистое свертывание (ДВС-синдром), гипергликемия, острый респираторный дистресс-синдром.
При возникновении острого панкреатита больного необходимо срочно госпитализировать (в течение 12-24 часов пациент должен быть помещен в отделение интенсивной терапии), поскольку, даже при условии соответствующего лечения, примерно 20-30% случаев острого панкреатита с тяжелым течением заканчиваются летально (летальный исход в большинстве случаев связан с развитием множественной органной недостаточности и присоединившейся инфекции).
Главным патологическим признаком острого панкреатита является повреждение ацинарных клеток, возникающее в результате массивного повышения выброса панкреатических ферментов в кровь. К ферментам ацинарных клеток относится альфа-амилаза. Само по себе повышение концентрации альфа-амилазы в крови не имеет каких-либо клинических последствий – этот фермент выступает в роли маркера повреждения поджелудочной железы. Повышение концентрации альфа-амилазы в крови происходит примерно через 2-12 часов после возникновения симптомов и остается высокой, как правило, в течение 3-5 дней.
Если уровень альфа-амилазы у пациента с болями в животе превышает верхнюю границу нормы референсных значений в 5 раз и более, можно подозревать острый панкреатит. Если уровень альфа-амилазы в крови превышает показатель 1000 ЕД/л, очень большая вероятность, что острая боль в брюшной полости вызвана панкреатитом. Отметим, что диагноз «острый панкреатит» нельзя исключать даже при показателе уровня альфа-амилазы ниже 1000 ЕД/л, поскольку у незначительной части пациентов с этой патологией уровень фермента повышается незначительно. В очень редких случаях концентрация альфа-амилазы в крови при остром панкреатите остается в пределах нормы.
Логично было бы предположить, что чем выше концентрация альфа-амилазы в крови, тем тяжелее панкреатит. Это не верно! На самом деле определение концентрации альфа-амилазы в крови не имеет прогностического значения на этапе первичной диагностики. Тем не менее, если этот показатель не возвращается в пределы нормы после приступа острого панкреатита, можно предполагать развитие позднего осложнения острого панкреатита – панкреатической псевдокисты (скопление панкреатического сока в грануляционных тканях).
Хронический панкреатит
Если при остром панкреатите повреждения поджелудочной железы, вызванные воспалением, проходят благодаря естественному восстановлению и функции органа восстанавливаются, то при хроническом панкреатите длительное, медленно развивающееся воспаление приводит к необратимым повреждениям.
Наиболее распространенная причина развития хронического панкреатита – злоупотребление алкоголем. Также хроническая патология поджелудочной железы может быть признаком гемохроматоза — генетическое заболевание, характеризующееся нарушением обмена железа, при котором происходит чрезмерное отложение железа в разных органах и тканях, в том числе и поджелудочной железе. Кроме этого, чрезмерное накопление железа в организме может быть вызвано и рядом других заболеваний: сахарный диабет, цирроз печени, артрит, сердечная недостаточность.
Главный симптом хронического панкреатита – периодическая или постоянная боль в животе (преимущественно в области левого подреберья). По причине дефицита панкреатических ферментов патология сопровождается нарушением усвоения пищи с последующей потерей массы тела, а также сахарным диабетом, вследствие поражения островков Лангерганса (островковых клеток поджелудочной железы). На начальных этапах развития хронического панкреатита концентрация альфа-амилазы в крови может незначительно увеличиваться. Со временем в результате воспалительного процесса продукция ферментов снижается, и концентрация альфа-амилазы возвращается в переделы нормы (может быть даже ниже).
Так как при хроническом панкреатите уровень альфа-амилазы может быть повышен, нормальным или сниженным, этот анализ малоинформативен при диагностике этой патологии.
Рак поджелудочной железы
Рак поджелудочной железы – одна из самых тяжелых форм злокачественного новообразования. При раке поджелудочной железы уровень альфа-амилазы в крови может оставаться в пределах нормы или незначительно повышаться. При диагностике рака поджелудочной железы этот анализ малоэффективен.
Другие заболевания поджелудочной железы
Концентрация альфа-амилазы в крови может повышаться (как правило, не превышает показатель 1000 ЕД/л) не только при панкреатите или раке поджелудочной железы, но и при некоторых других патологиях, например, заболевания гепатобилиарной системы (холецистит), перфоративная язва желудка, кишечная непроходимость. Эти состояния вызывают острую боль в животе, поэтому больному с высокой концентрацией альфа-амилазы в крови на фоне боли в животе не всегда диагностирую острый панкреатит. Повышение уровня альфа-амилазы могут вызывать травмы живота, причем, которые не затрагивают поджелудочную железу. После хирургического вмешательства в органы брюшной полости концентрация альфа-амилазы тоже может повышаться.
Так как амилаза выводится из организма через почки с мочой, у больных с почечной недостаточностью (острой или хронической) концентрация альфа-амилазы в крови может быть повышена. Одним из признаков диабетического кетоацидоза также является повышение концентрации этого фермента в крови. Повышение уровня амилазы может быть вызвано патологией (повреждением) околоушных слюнных желез (в слюнных железах образуется слюнная амилаза), например, после челюстно-лицевых операций, при эпидемическом паротите.
Макроамилаземия – редкое доброкачественное состояние, при котором повышается уровень амилазы в крови (амилаза обнаруживается в крови в соединении с сывороточными белками или в форме макромолекулярных агрегатов). Такие молекулы не способны преодолеть клубочковые мембраны почек из-за своих больших размеров, поэтому не выделяются с мочой и остаются в крови.
Основные причины повышения уровня амилазы в крови
- Панкреатит (острый и хронический)
- Почечная недостаточность (острая и хроническая)
- Холецистит (острый и хронический)
- Диабетический кетоацидоз
- Перфоративная язва желудка
- Кишечная непроходимость
- Травма живота
- Эпидемический паротит
- Макроамилаземия
Источник
Дифференциальная диагностика заболеваний, приводящих к гиперамилаземии, обширна и разнообразна, и первое заболевание, которое необходимо исключить, – это панкреатит. Чаще всего острый панкреатит и/или обострение хронического панкреатита приводят к гиперамилаземии, которая сопровождается гиперамилазурией (повышением уровня диастазы мочи) и целым симптомокомплексом, главенствующую роль в котором играет боль. Именно поэтому многие врачи при сочетании болей в животе и гиперамилаземии чаще всего ставят диагноз «панкреатит». Всегда ли этот диагноз правомерен? Представленный клинический случай гиперамилаземии у больной целиакией демонстрирует вариабельность заболеваний, сопровождающихся гиперамилаземией, и показывает, насколько важно вовремя и точно установить ее причину.
Для цитирования: Никольская К.А., Бордин Д.С., Винокурова Л.В., Малых М.В., Дубцова Е.А. Гиперамилаземия – всегда ли это панкреатит? Фарматека. 2019;26(2):130–35. DOI: https://dx.doi.org/10.18565/pharmateca.2019.2.130-135
Чаще всего гиперамилаземия (ГАЕ) служит маркером заболеваний поджелудочной железы (ПЖ) – острого панкреатита (ОП), хронического панкреатита (ХП), рака ПЖ. Однако в 8% случаев ГАЕ сочетается с нормальным содержанием амилазы в моче и не сопровождается другими симптомами [1].
Нередко появление ГАЕ врачи расценивают как проявление панкреатита, не обращая внимания на отсутствие каких-либо других проявлений этого заболевания. В настоящее время исследование уровня амилазы в крови входит в рутинный скрининг биохимических анализов, в связи с чем бессимптомная ГАЕ выявляется все чаще, причем стандартные диагностические методы (сбор анамнеза, физикальное обследование, трансабдоминальное ультразвуковое исследование (УЗИ) органов брюшной полости) не всегда выявляют какую-либо патологию, объясняющую лабораторные отклонения. Общепринятого алгоритма диагностического поиска в таких случаях на сегодняшний день не существует [2].
Чтобы не ошибиться в диагнозе при наличии гиперамилаземии, важно помнить, что не всегда ее причиной служат заболевания ПЖ [3–5]. Если при проведении банального УЗИ органов брюшной полости есть изменения, характерные для панкреатита, то необходимо провести более тщательное обследование пациента с применением таких инструментальных исследований, как мультиспиральная компьютерная томография с внутривенным контрастированием, магнитно-резонансная томография и как уточняющий метод – эндоскопическая ультрасонография. Кроме ОП и обострения ХП к ГАЕ могут приводить новообразования ПЖ [6] и ее травмы, а также различные осложнения панкреатита, такие как псевдокисты ПЖ.
В 1964 г. P. Wilding, et al. [7] описали пациента с длительной ГАЕ без клинических проявлений панкреатита. Наличие повышения уровня фермента было объяснено его связыванием с сывороточным глобулином. Через 3 года Р. Berk, et al. [8] описали еще троих пациентов с подобными проявлениями, также без панкреатита, и предложили термин «макроамилаземия» (МАЕ) для обозначения отдельной формы ГАЕ.
По мнению данных авторов, МАЕ возникает вследствие образования и циркуляции в крови комплексов нормальной сывороточной амилазы с белками или углеводами [9]. Данные комплексы имеют большую молекулярную массу, вследствие чего плохо фильтруются почками. Вес молекулы макроамилазы может составлять от 150 тыс. до 2 млн Д, тогда как молекулярный вес обычной молекулы амилазы человека составляет 50–55 тыс. Д [10]. Крупные молекулы задерживаются в кровотоке, что подтверждается высоким уровнем амилазы в крови и низким уровнем амилазы в моче [11, 12]. МАЕ встречается у 0,1% всей популяции [13] и описана у 2,9% госпитализированных пациентов [14–16]. Таким образом, МАЕ может быть причиной ГАЕ неуточненной этиологии [17]. По данным многоцентровых исследований, у 6–9,6% пациентов с ГАЕ, выявленной при рутинном обследовании, диагностируется МАЕ [18, 19].
При таких ситуациях клинические проявления могут отсутствовать, а пациенты длительно безрезультативно обследуются с проведением высокотехнологичных, нередко инвазивных методик. При сочетании МАЕ с болями в животе пациентам могут выполнять диагностические оперативные вмешательства [20].
В исследовании Н.Б. Губергриц и соавт. (2007) [12] показано, что МАЕ встречается у 11% больных ХП. У 3–5% пациентов с повышенным уровнем сывороточной амилазы имела место МАЕ. Сочетание ГАЕ и соотношения клиренсов амилазы и креатинина
Существует несколько методов диагностики МАЕ: электрофорез в агаре образца сыворотки, осаждение полиэтиленгликолем, методы ускоренной жидкостной хроматографии и комбинированной иммунохимической технологии. Однако использование данных методов либо трудоемко и требует наличия сложно лабораторной техники, либо высокозатратно [21, 22, 12].
Одним из наиболее простых и доступных методов диагностики МАЕ является определение соотношения клиренсов амилазы (Ка) и креатинина (Кк). Данный показатель вычисляют по следующей формуле:
Ка⁄Кк=Амочи/Акрови×Ккрови/Кмочи×100 %,
где А мочи – уровень амилазы в суточной моче, А крови – уровень амилазы в крови натощак; К мочи – уровень креатинина в суточной моче, К крови – уровень креатинина в крови натощак [9].
В норме амилазокреатининовый клиренс составляет 1–2,5% [9]. При панкреатите соотношение клиренсов превышает 2,5 %, даже в отсутствие ГАЕ, а при МАЕ снижается до менее 1%.
В литературе описаны многочисленные случаи ГАЕ и МАЕ при экстраабдоминальных заболеваниях и патологиях непакреатического генеза [23].
Известно, что повышение уровня амилазы может быть связано с некоторыми видами неоплазии экстрапанкреатической локализации. В таких случаях чаще повышается панкреатическая амилаза (амилаза Р-типа), отражающая синтез амилазы опухолевыми клетками или повышающаяся из-за деструкции здоровых окружающих тканей. Высокий уровень амилазы слюны (амилаза S-типа) чаще всего связан с раком ПЖ и может говорить о ее синтезе тканями опухоли, т.к. в железе может синтезироваться только амилаза Р-типа.
Амилазу S-типа синтезируют также и серозные опухоли яичников, что неудивительно, т.к. они похожи на пограничные клетки фаллопиевых труб, которые в норме продуцируют этот фермент. Амилаза из клеток опухолей яичников в значительной степени соответствует амилазе S-типа. Также амилаза встречается в нормальной легочной ткани, и ГАЕ имеет место при различных легочных заболеваниях, например при пневмонии [24] или инфаркте легкого [25].
В литературе описано несколько случаев ГАЕ у пациентов с новообразованиями различной локализации. Так, например, R.W. Anunann, et al. [24] представили случай ГАЕ при раке легкого. Амилаза продуцировалась метастатическом очагом рака легкого в печени. Также в данном исследовании содержатся данные о выработке изоферментов, сходных по строению с амилазой S-типа, при первичном раке ПЖ. Японские ученые (Т. Gao, et al. [26]) описали образование подобных изоферментов амилазы у пациента с первичным раком легкого. Также в Японии имел место случай МАЕ у 78-летней женщины, связанный с папиллярной аденокарциномой щитовидной железы. Амилаза сыворотки у данной пациентки была повышена в несколько раз при нормальном уровне липазы. МАЕ была подтверждена при проведении электрофореза и хроматографии [27].
Американскими учеными в 1992 г. был описан впервые зарегистрированный случай иммунопролиферативного заболевания тонкой кишки, сопровождающегося МАЕ, связанной с IgA, без клинических проявлений (отсутствие диареи), несмотря на тотальную атрофию ворсинок, и ассоциированную с гипотиреозом [28].
Кроме неоплазий, ГАЕ и МАЕ встречаются при воспалительных заболеваниях кишечника (ВЗК). В Греции в 2006 г. было проведено ретроспективное исследование 211 пациентов с ВЗК на наличие ГАЕ. Повышение уровня амилазы крови, хотя бы однократно, зарегистрировано у 21 больного. Только в одном случае у пациента с болезнью Крона выявлена ГАЕ, расцененная как проявление панкреатита на фоне приема азатиоприна, в остальных случаях ГАЭ протекала без клиники панкреатита и структурных изменений со стороны ПЖ [29]. В мультицентровом американском исследовании, включившем 180 больных ВЗК (83 с язвенным колитом, 97 с болезнью Крона), ГАЕ была выявлена у 8 из 97 пациентов с болезнью Крона (8%), причем у четверых из них определялась повышенная изоамилаза ПЖ и у двоих – повышенная липазная активность. Отсутствовала связь ГАЕ с локализацией, активностью и продолжительностью ВЗК или проводимой терапией, ни у одного из пациентов не было клинических признаков панкреатита [30].
Еще одной причиной ГАЕ непанкреатогенного генеза служит целиакия. Частота повышения уровня ферментов ПЖ в сыворотке крови у пациентов с целиакией мало изучена.
В Балтиморском университете в 2001 г. проведено исследование, включившее 124 пациента с нелеченой целиакией (положительные тесты на антиэндомизий и тканевую трансглутаминазу), 100 пациентов с целиакией на аглютеновой диете (АГД) с отрицательными результатами серологического теста и 89 здоровых лиц. У 23 больных нелеченой целиакией выявлено повышение уровня сывороточной амилазы (>2 SD выше контрольного). Средние уровни общей амилазы и макроамилазы были значительно повышены в обеих группах больных целиакией. Уровни неосажденной амилазы (фракция амилазы ПЖ и слюны) не отличались от таковых в контрольной группе. У 3 (3,4%) здоровых лиц, 21 (16,8%) пациента с нелеченой целиакией и 7 (7%) пациентов на АГД была значительно повышена активность макроамилазы [31].
В исследовании 2006 г., проведенном в Италии (Палермо) с участием 90 взрослых пациентов и 112 детей с целиакией, были оценены показатели изоамилазы ПЖ и липазы в сыворотке крови до начала АГД и спустя 12 месяцев на фоне ее соблюдения. В подгруппе взрослых были проанализированы уровни эластазы сыворотки и трипсина. Кроме того, выполнено УЗИ поджелудочной железы. Установлено, что на момент постановки диагноза целиакии у 26 (29%) взрослых и 29 (26%) детей выявлено повышение уровня амилазы и/или липазы; уровень трипсина был повышен в 69% случаев, эластазы – в 19%. Частота повышения уровней ферментов ПЖ была сходной для пациентов с «типичными» и «атипичными» симптомами целиакии, а также в случаях ее бессимптомного течения. В основном выявлялось повышение уровня ферментов до двух нормальных значений. Данные изменения не были связаны с употреблением алкоголя, наркотических препаратов, а также с наличием болевого синдрома и сахарного диабета. УЗИ органов брюшной полости показало отсутствие патологических изменений со стороны ПЖ во всех случаях. Через 12 месяцев соблюдения АГД повышение уровня амилазы ПЖ выявлено в 3 случаях, а липазы – в 2; следует отметить, что эти пациенты не в полной мере придерживались АГД [32].
Таким образом, ГАЕ может сопровождаться не только ОП и ХП, но и ряд других состояний (рис. 1).
Клинический случай
Больная С. 55 лет в августе 2018 г. была госпитализирована в отделение патологии поджелудочной железы и желчевыводящих путей МКНЦ им. А.С. Логинова с диагнозом ХП.
При поступлении пациентка предъявляла жалобы на периодически возникающий дискомфорт в правом подреберье, сухость во рту, вздутие и урчание в животе, склонность к задержке стула.
Анамнез заболевания
Из анамнеза известно, что в 1981 г. больной был поставлен диагноз «первичное бесплодие». Однако в 1990 г. она родила в срок здорового ребенка. Беременность протекала с анемией (гемоглобин – 90 г/л на фоне приема препаратов железа). В 2016 г. пациентка отметила появление дискомфорта в животе и обратилась в поликлинику по месту жительства, где при обследовании выявлена ГАЕ до 3–4 норм. При УЗИ – умеренные диффузные изменения ПЖ, при эзофагогастродуоденоскопии (ЭГДС) – хронический гастрит. На основании полученных данных был установлен диагноз «хронический панкреатит, обострение». Пациентке предложено стационарное лечение, от которого она отказалась. В течение последующих 2 лет проводилась терапия полиферментными препаратами в минимикросферах в суточной дозе 125 тыс. ЕД липазы, спазмолитиками, 1 раз в 3–4 месяца проводился контроль уровня амилазы крови, увеличение которого 3–4 раза выше нормального сохранялось. Кроме того, за последние полтора года вес пациентки снизился на 8 кг.
Данные физикального обследования
Общее состояние удовлетворительное. Кожные покровы и видимые слизистые оболочки обычной окраски и влажности, тургор кожи снижен, пониженного питания (индекс массы тела 18,3 кг/м2). В легких дыхание везикулярное, хрипов нет, частота дыханий 16 в минуту. Частота сердечных сокращений 68 в минуту. Артериальное давление – 130/90 мм рт. ст. Живот не вздут, при пальпации мягкий, безболезненный. Печень у края реберной дуги. Селезенка не пальпируется.
Диагностика
По данным лабораторных исследований, отмечено повышение уровня амилазы крови до 411 ЕД/л (норма до 100 ЕД/л) с сохранением нормального уровня амилазы мочи, незначительно выраженный цитолиз и снижение уровня сывороточного железа до 4,7 мкмоль/л (табл. 1).

Остальные показатели клинического и биохимического анализов крови в пределах референсных значений.
УЗИ. Размеры печени не увеличены – косой внутренний размер правой доли 133 мм (норма до 150 мм), толщина левой доли 58 мм (норма до 60 мм), контур ровный. Эхоструктура паренхимы печени неоднородная, эхогенность незначительно повышена, сосудистый рисунок не изменен.
Воротная вена не расширена – 11 мм, просвет однороден. Объемных образований не выявлено. Внутрипеченочные желчные протоки не расширены. Общий желчный проток 4 мм в диаметре, на доступном осмотру участке его просвет однороден. Желчный пузырь с перетяжками в теле и дне, в размерах не увеличен – 98×18 мм, стенки не утолщены. Содержимое пузыря однородное, конкременты не определяюттся. Паравезикальная область не изменена.
ПЖ обычной формы, контуры четкие, ровные. Размеры: головка 27 мм (норма до 30 мм), тело 14 мм (норма до 20 мм), хвост 23 мм (норма до 35 мм). Эхоструктура ткани ПЖ неоднородная, эхогенность незначительно повышена. Главный панкреатический проток не расширен.
Селезенка не увеличена – 83×32 мм, контур ровный, ткань однородная. Селезеночная вена не расширена.
В желудке неоднородное жидкостное содержимое. Свободной жидкости в брюшной полости не выявлено.
Заключение: ультразвуковые признаки незначительных диффузных изменений печени, ПЖы, деформации желчного пузыря.
ЭГДС. Слизистая оболочка бульбодуоденального перехода отечная, имеет «мозаичный» рисунок, далее в вертикальной части 12-перстной кишки слизистая оболочка истончена, складки не визуализируются, в нисходящей части 12-перстной кишки слизистая оболочка отечная, складки местами сглажены, перистальтика активная (рис. 2).
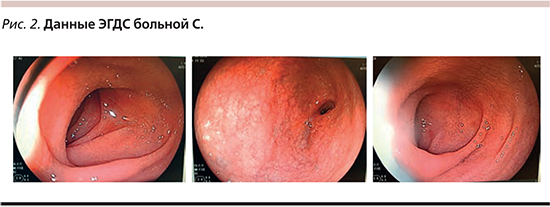
Заключение: дуоденит – эндоскопическая картина наиболее соответствует целиакии.
Пациентке была выполнена биопсия залуковичного отдела 12-перстной кишки. В биоптате фрагменты слизистой оболочки тонкой кишки. Кишечные ворсины сглажены. Поверхность слизистой оболочки, сохранившаяся на небольшом протяжении, выстлана клетками эпителия кубической формы. Количество бокаловидных клеток снижено. Число межэпителиальных лимфоцитов увеличено (до 35 на 100 эпителиоцитов). Глубина крипт увеличена. Соотношение ворсина/крипта не превышает 1:1, часть – разрушены и деэпителизированы с поверхностными эрозиями. Строма сильно инфильтрирована лимфоцитами, плазмоцитами с примесью нейтрофилов и эозинофилов. Собственная пластинка отечна и умеренно инфильтрирована лимфоцитами и плазмоцитами. Умеренная гиперплазия бруннеровых желез.
Заключение: морфологическая картина более соответствует глютеновой энтеропатии, MARSH IIIа. Хронический активный эрозивный дуоденит.
Также было выполнено иммунологическое исследование, которое обнаружило повышение титра антител к тканевой трансглутаминазе IgA в 10 раз, к деамидированным пептидам глиадина IgG – более чем в 6 раз, к деамидированным пептидам глиадина IgA – в 8 раз (табл. 2).
Заключительный диагноз
На основании вышепредставленных данных пациентке был выставлен заключительный клинический диагноз «целиакия, латентная форма» и назначена АГД.
Через 3 месяца уровень амилазы крови у пациентки нормализовался, прибавка в весе составила 8 кг.

Заключение
Особенностью представленного клинического случая явилась гипердиагностика ХП. Диагноз был установлен только на основании повышения уровня амилазы крови без каких-либо клинических проявлений и инструментального подтверждения. В течение двух лет больная безуспешно лечилась полиферментными препаратами: ГАЕ сохранялась и продолжалось снижение массы тела. После установления диагноза «целиакия, латентная форма» и назначения АГТ уровень амилазы крови нормализовался и восстановилась масса тела.
Подобные наблюдения представили А. Carroccio, et al. [32], также отметившие нормализацию уровня амилазы крови на фоне соблюдения АГД у больных целиакией.
1. Тихонова Т.А. Гиперамилаземия – угрожающий симптом или безопасная находка? Бюллетень медицинских интернет-конференций. 2016;6(6).
2. Красновский А.Л., Григорьев С.П., Золкина И.В. и др. Бессимптомная панкреатическая гиперферментемия. Российский медицинский журнал. 2014;5:52–56.
3. Logie J.J., Cox M., Sharkey J. A multidisciplinary approach to an unusual cause of hyperamylasaemia. BMJ CaseRep. 2015;6:2015209780. Doi: 10.1136/bcr-2015-209780.
4. Shah K.S., Shelat V.G., Jogai S., Trompetas V. Primary gallbladder lymphoma presenting with perforated cholecystitis and hyperamylasaemia. Ann R CollSurg Engl. 2016;98(2):13–5. Doi: 10.1308/rcsann.2016.0001.
5. Sinha S., Khan H., Timms P.M., Olagbaiye O.A. Pancreatic-type hyperamylasemia and hyperlipasemia secondary to ruptured ovarian cyst: a case report and review of the literature. J Emerg Med. 2010;38(4):463–66. Doi: 10.1016/j.jemermed.2008.04.042.
6. Matsuura H., et al. Four cases of macroamylasemia malignant tumor. Bull Hygo Cancer Hosp. 1981;12:59.
7. Wilding P., Cooke W.T., Nicholson G.I. Globulin-bound amylase. Ann. Intern. Med. 1964;64:1053–56.
8. Berk J.E., Kizu H., Wilding P., Searcy R.L. Macroamylasemia: a newly recognized cause for elevated serum amylase activity. N Engl J Med. 1967;277:941–46.
9. Губергриц Н.Б., Лукашевич Г.М., Загоренко Ю.А.Макроамилаземия – безобидное заблуждение или опасное незнание? Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2007;5:64–70.
10. Levitt M.D. Study of macroamylase complexes. J Lab Clin Med. 1972;80:414–22.
11. Haubrich W.S., Schaffner F., Berk J.E. Macroamylasemia. Bockus gastroenterology.5th ed. Philadelphia: WB Saunders, 1995.P. 2851–60.
12. Губергиц Н.Б., Голубова О.А. Макроамилаземия у больных с хроническим панкреатитом. Вопросы реконструктивной и пластической хирургии. 2014;1(48):75–80.
13. Imrie C.W., King J., Henderson A.R. Macroamylasemiae survey of prevalence in a mixed population. N Engl J Med. 1972;287–931.
14. Barrows D., Berk J.E., Fridhandler L. Macroamylasemiae survey of prevalence in a mixed population. N Engl J Med. 1972;286:1352.
15. Berk J.E., Fridhandler L. The prevalence of macroamylasemia. Further study. Am J Gastroenterol 1974;62:54–8.
16. Boyle C.E.L., Fraser C.G. Macroamylasaemia: how common is it? Br Med J. 1985;291;1389.
17. Gubergrits N., Golubova O., Lukashevich G., Fomenko P. Elevated serum amylase in patients with chronic pancreatitis: Acute attack or macroamylasemia? Pancreatology. 2014;14:114–16. Doi: 10.1016/j.pan.2013.12.004.
18. Forsman R.W. Macroamylase: Prevalence, distribution of age, sex, amylase activity, and electrophoretic mobility. Clin Biochem. 1986;19:250–53.
19. Warshaw A.L., Hawboldt M.M. Puzzling persistent hyperamylasemia, probably neither pancreatic nor pathologic. Am J Surg. 1988;155:453–56.
20. Губергриц Н.Б., Лукашевич Г.М., Загоренко Ю.А.Макроамилаземия – безобидное заблуждение или опасное незнание? Сучасна гастроентерологія. 2006;6(32):93.
21. Mifflin T.E., Benjamin D.C., Bruns D.E. Rapid quantitative, specific measurement of pancreatic amylase in serum with use of a monoclonal antibody. Clin Chem. 1985;31(8):1283–88.
22. Mifflin T.E., Forsman R.W., Bruns D.E. Interaction of immobilized anti-salivary amylase antibody with human macroamylases: implications for use in a pancreatic amylase assay to distinguish macroamylasemia from acute pancreatitis. Clin Chem. 1989;35:1651–54.
23. LottJ A., Ellison E.C. Amylase assay and diagnosis of pancreatic disease
24. Anunann R.W., Berk J.E., Fridhandler L., et al. Hyperamylasemia with carcinoma of the lung. Ann Intern Med. 1973;78:521–25.
25. Warshaw A.L., Lee K.H. Characteristic alterations of serum isoenzymesofamylase in diseasesofliver, pancreas,salivarygland,lung, and genitals. J Surg Res. 1977;22:362–69.
26. Gao T., Eto K., Nakayama J., et al. Abnormalamylasein a patient with malignant tumor. Med Biol (Tokyo). 1971;82:53–6.
27. Ishizuka T., Yasuda K., Kajita K., et al. Macroamylasemiaassociated with thyroid cancer, elevated serum thyroxine-binding globulin(TBG),chronic pancreatitis, and gastrointestinal polyposis. Gastroenterol Jpn. 1986;21:385–90.
28. Blumstein M., Bank S., Greenberg R.E., et al. Immunoproliferative small intestinal disease in an American patient with lymphoma and macroamylasemia. Gastroenterology. 1992;103(3):1071–74.
29. Katsanos K.Н., Kolios G., Tsianos G.V., Tsianos E.V.Hyperamylasemia in inflammatory bowel disease: report of a case with literature review. Ann Gastroenterol. 2004;17(3):306–12.
30. Katz S., Bank S., Greenberg R.E., et al. Hyperamy lasemia in inflammatory bowel disease. J Clin Gastroenterol. 1988;10(6):627–30.
31. Rabsztyn A., Green P.H.R., Berti I., et al. Macroamylasemia in patients with coeliac disease. Am J Gastroenterol. 2001;96:1096–100.
32. Carroccio A., Di Prima L., Scalici C., et al. Unexplained elevated serum pancreatic enzymes: a reason to suspect celiac disease. Clin Gastroenterol Hepatol. 2006;4(4):455–59.
Источник