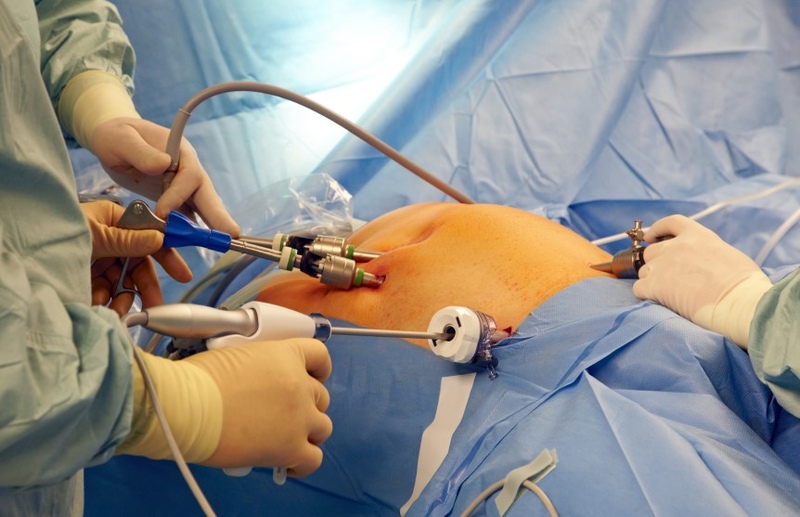
Постановка эпидурального катетера при панкреатите
12.12.2014
Эпидуральная анестезия: расширяем горизонты применения
Любому анестезиологу давно и много известно об эпидуральной анестезии-анальгезии. Начиналось все с многоразовой длинной эпидуральной иглы без пальцевых упоров, стеклянного шприца и однократно вводимой, довольно большой дозы лидокаина. С тех пор многое изменилось. Появился шприц «потери сопротивления», эпидуральный катетер, плоский эпидуральный фильтр, коннекторы катетера различных конструкций. Появилось главное: возможность выполнения продленной эпидуральной блокады.
В каких же ситуациях мы чаще всего используем продленную эпидуральную анестезию?
- Обезболивание нормально протекающих родов. Сюда же отнесем и анестезию на операцию кесарева сечения.
- Анестезия травматологических и ортопедических операций на нижних конечностях и тазу.
- В составе комбинированной анестезии при гинекологических и урологических операциях на органах малого таза.
- В составе комбинированной анестезии при операциях на органах брюшной полости.
- В составе комбинированной анестезии при операциях на органах грудной полости.
Да, все это не новость. Все это любой анестезиолог делает рутинно, изо дня в день. Казалось бы, о чем еще говорить? А вот о чем: о второй части названия нашей специальности-реаниматолог. Да-да! Считаю, что и в работе палат интенсивной терапии, без эпидуральной анестезии, в современных условиях, никуда.
Итак, в каких ситуациях продленная эпидуральная анестезия может помочь реаниматологу:
- Консервативная терапия острого панкреатита тяжелого течения и панкреонекроза. Первая жалоба такого пациента: упорный абдоминальный болевой синдром. Чем его обезболить? НПВС?- нельзя! Слизистая желудка у пациентов этой категории уже «скомпрометирована», и осложнения в виде эрозивного гастрита или острой язвы желудка никому не нужны. Наркотические анальгетики?-тоже не лучший выбор! Все опиаты в той или иной степени вызывают спазм сфинктера Одди, нарушается отток желчи, панкреатит грозит перейти в холецистопанкреатит, холестатический гепатит, механическую желтуху. Остается практически единственный и правильный выбор-продленная эпидуральная блокада! Вторая жалоба такого пациента: вздутие живота. Парез кишечника практически всегда сопровождает панкреатит. Возникает так называемое «третье пространство», идет сброс электролитов и жидкости в просвет кишечника, следующая за этим гемоконцентрация ведет к ухудшению реологических свойств крови. Нарушается кровоснабжение всех органов и тканей, а воспаленной отечной поджелудочной железы в особенности. Выбор препаратов для лечения пареза кишечника сейчас довольно ограничен. Остается-продленная эпидуральная анестезия. Основной патогенетический механизм развития острого панкреатита- спазм протоков поджелудочной железы, нарушение оттока панкреатических ферментов. Наряду со спазмолитиками в борьбе с этим поможет и эпидуральная блокада. Таким образом, продленная эпидуральная блокада размыкает порочный круг спазм-боль-парез, и оказывает в большей степени патогенетическое действие, нежели симптоматическое. Пункция эпидурального пространства при лечении острого панкреатита-панкреонекроза выполняется на уровне Th7-Th8. Катетер заводится краниально на 3-4см. Вводится тест-доза лидокаин 2%-20мг. После этого возможно введение болюса (лидокаин 2%-6-8мл, ропивакаин 0.5%-8-10мл). В дальнейшем блокада поддерживается непрерывной инфузией низкоконцентрированного анестетика (чаще ропивакаин 0.2%-6-8-10мл/час). Оценка эффективности эпидуральной блокады проводится по клиническим признакам: отсутствие или значительное уменьшение интенсивности болевого абдоминального синдрома, уменьшение вздутия живота, появление и улучшение перистальтики кишечника, отхождение газов. Так же улучшаются и лабораторные показатели: снижается лейкоцитоз крови, амилаза крови, диастаза мочи. На УЗИ-картине видно уменьшение отека поджелудочной железы, отсутствие или уменьшение количества свободной жидкости в брюшной полости, сальниковой сумке. Объясню почему: улучшается отток панкреатического секрета, стихает воспалительный процесс, уменьшается экссудация и отек.
- Лечение астматического статуса. До сих пор идут споры об эффективности и целесообразности эпидуральной блокады в этой ситуации. Многих смущает выполнение процедуры у пациента, находящего в столь тяжелом состоянии. Но представьте себе картину: пациент сидит с фиксированным плечевым поясом, резкий цианоз, экспираторная одышка до 40 в минуту, мокрота не отходит, «немое легкое», глюкокортикостероиды и эуфиллин введены, эффекта нет. Что делать? ИВЛ? В таких условиях ИВЛ окажется не столь эффективной ( мелкие бронхи спазмированы и забиты мокротой, альвеолярный обмен невозможен). И здесь самое время начать мыслить не-стандартно! Есть мнение, что денервированный орган становится более чувствителен к гуморальной ( медиаторной, гормональной) регуляции. Таким образом, эффективность гормональной терапии в таком органе возрастает. Как денервировать легкое? Правильно! Эпидуральная блокада на верхнегрудном уровне! Вторая точка приложения ее- сосуды. Уходит спазм легочных сосудов, улучшается газообмен на альвеолярной мембране, улучшается оксигенация тканей. И наконец, третья точка приложения эпидуральной блокады-бронхи. Спазм мелких бронхов также уменьшается, начинает отходить мокрота, улучшается альвеолярный газообмен. Пункция эпидурального пространства при лечении астматического статуса выполняется на уровне Th4-Th5. Катетер заводится краниально на 3-4см. Вводится тест-доза лидокаин 2%-10мг. После этого возможно введение болюса (лидокаин 2%-3-5мл, ропивакаин 0.5%-4-6мл). В дальнейшем блокада поддерживается непрерывной инфузией низкоконцентрированного анестетика (чаще ропивакаин 0.2%-4-6-8мл/час).
- Лечение облитерирующего артериита сосудов нижних конечностей. В этой ситуации все очевидно- обращаем побочный эффект в основной! А именно, медикаментозная десимпатизация. Простой аналог симпатэктомии. При выполнении эпидуральной блокады развиается выраженная периферическая вазоплегия, в следствие прекращения симпатической иннервации стенки сосудов. Улучшается периферический кровоток. Уменьшается ишемия дистальных отделов конечностей. Также, купируется болевой синдром, при его наличии. К сожалению, в этой ситуации, эпидуральная анестезия может рассматриваться лишь как средство временной симптоматической терапии и не ведет к выздоровлению пациента. Пункция эпидурального пространства при лечении облитерирующего артериита сосудов нижних конечностей выполняется на уровне L3-L4. Катетер заводится краниально на 3-4см. Вводится тест-доза лидокаин 2%-20мг. После этого возможно введение болюса (лидокаин 2%-6-8мл, ропивакаин 0.5%-8-10мл). В дальнейшем блокада поддерживается непрерывной инфузией низкоконцентрированного анестетика (чаще ропивакаин 0.2%-6-8-10мл/час). Оценка эффективности эпидуральной блокады проводится по клиническим признакам: купирование болевого синдрома, уменьшение признаков ишемии конечности( потепление кожи, исчезновение бледности и цианоза). Непрерывную инфузию у такого пациента целесообразно проводить с использованием одноразовых эластомерных инфузионных помп, что не нарушая мобильности пациента, позволяет сохранить стабильную скорость инфузии и соблюсти асептику.
В заключение статьи процедура выполнения эпидуральной блокады и некоторые особенности современных наборов для процедуры представлены ниже на фотографиях.

Пальпация межостистых промежутков на грудном уровне.

Особенностью иглы Туохи в наборе «Минипак» марки Portex является возможность установки широких пальцевых упоров с углублениями в удобном для врача положении.

Второй оригинальный компонент эпидуральных наборов Portex наклейка для фиксации катетера Locklt Plus. Пенная прокладка с адгезивным слоем позволяет прочно закрепить катетер на коже пациента, не доставляя ему дискомфорта и не вызывая раздражения. Плоский прозрачный механизм надежно фиксирует катетер, позволяет врачу с легкостью наблюдать за местом выхода катетера, не доставляет неудобств пациенту.

Коннектор для катетера EpiFuse является стандартным компонентом эпидуральных наборов Portex. Единственный коннектор имеющий замковый механизм закрывания, для открытия которого не достаточно просто рук, что исключает случайное открытие пациентом или медперсоналом. Коннектор открывается с помощью шприца Луэр. Имеет отчетливый щелчок при закрывании. Желтый цвет корпуса облегчает идентификацию в качестве эпидурального катетера. Плоская форма повышает комфорт пациента.



Открывание коннектора с помощью шприца Луэр.

Эпидуральный катетер. Хорошо видна разметка по длине.

Шприц «потери сопротивления».

Эпидуральный плоский фильтр. Срок использования до 96 часов.

И так, процедура! Двукратная обработка кожи антисептиком.

Проведение местной анестезии раствором лидокаина 2%-4.0 мл.

Проведение местной анестезии раствором лидокаина 2%-4.0 мл.

Установка эпидуральной иглы в межостистом промежутке. Прохождение межостистой связки иглой с мандреном. Хорошо видна разметка иглы. Первые четыре сантиметра от кончика разметки нет. Это объясняется тем, что у взрослых пациентов глубина введения иглы не менее 4-4.5см. Для облегчения подсчета глубины введения катетера нет смысла размечать иглу от самого кончика.

Извлечение мандрена.

Дальнейшее продвижение иглы, с постоянным давлением на поршень шприцы «утраты сопротивления». Хорошо виден угол введения иглы (до 45-ти градусов т. к. пункция выполняется на среднегрудном уровне).

Воздух из шприца легко вводится- эпидуральное пространство идентифицировано!

Введение эпидурального катетера через иглу Туохи, кончик которой расположен в эпидуральном пространстве.

Катетер заведен до тройной метки (на 15см). Таким образом, длина части катетера, находящейся в эпидуральном пространстве составляет 4см.

Осторожно извлекаем иглу, слегка подталкивая катетер внутрь.

Игла извлечена.

Подтягиваем катетер на нужную глубину. Длина части иглы от кожи до эпидурального пространства составила 5 см+4см в эпидуральном пространстве. Значит общая длина катетера о кожи составит 9см. Устанавливаем по метке.

Протаскиваем оставшуюся снаружи часть катетера через замок накожного фиксатора.

Вставляем дистальный кончик катера в коннектор и закрываем его с хорошо различимым щелчком.

Выполняем аспирационную пробу. При получении крови или ликвора необходимо немедленно удалить катетер!!!

Надежно фиксируем к коннектору плоский эпидуральный фильтр.

Фиксируем катетер к коже.

Фиксируем катетер к коже.

Фиксируем катетер к коже.

Прозрачная крышка замкового механизма закрыта.

Фиксация оставшейся части катетера широким пластырем из нетканого материала.
Коллеги, дорогу осилит идущий! Всем удачи!
Заведующий отделением
анестезиологии-реанимации
ФГБУЗ «ЦМСЧ-21» ФМБА России
Нечунаев А.С.
Заказать набор для эпидуральной анестезии с фиксатором Минипак

Источник
В
последние годы смертность при остром
панкреатите значительно уменьшилась,
что связывают с возросшими возможностями
лечения. Прогноз при остром панкреатите
прямо зависит от стадии заболевания.
При первой стадии — смертность наименьшая
(1—3 %), а при третьей достигает 80— 100 %.
Таким образом, чем раньше начато лечение,
тем лучше прогноз.
Патофизиологические
изменения. Патогенез
панкреатита основывается на процессе
самопереваривания поджелудочной железы
в результате активизации ее ферментов.
Активизация калликреина, трипсина и
фосфолипазы А с образованием токсинов
(лизолецитин) играет ведущую роль в
патогенезе заболевания. Возникают
некрозы поджелудочной железы и жировой
ткани, кровоизлияния в ткани, окружающие
железу с симптомокомплексом системных
и полиорганных нарушений.
Клиническая
картина.
В
зависимости от стадии процесса различают
три степени тяжести:
I
степень (или
стадия I) характеризуется сильными
болями в эпигастральной области,
нередко опоясывающего характера, с
иррадиацией в спину и в область грудной
клетки, покраснение лица, повышением
температуры тела, легким защитным
напряжением мышц живота. Лабораторные
данные: повышение содержания липазы,
менее специфично повышение амилазы.
Эту стадию обычно связывают с отеком
поджелудочной железы. Под влиянием
консервативного лечения быстро
наступает улучшение состояния больного.II
степень (стадия
II) характеризуется прогрессированием
болевого синдрома, интенсивной
постоянной «жестокой», «сверлящей»,
«пронизывающей» болью в эпигастральной
области с иррадиацией влево или вправо,
в спину, болью в верхней половине живота
и опоясывающей. Отчетливое защитное
напряжение мышц живота, метеоризм,
ослабление перистальтики кишечника.
В эпигастральной области иногда
определяется опухоль. Возможны
дыхательные, циркуляторные и другие
нарушения. Лабораторные данные:
повышение ферментов, сахара крови,
лейкоцитоз. При интенсивном лечении
улучшение замедленное.III
степень (стадия
III). В этой стадии все отчетливее
прослеживается перитонеальная
симптоматика: тошнота, рвота, парез
желудочно-кишечного тракта, напряжение
мышц брюшной стенки, обезвоживание,
лейкоцитоз. Системные и органные
нарушения: дыхательная, сердечно-сосудистая,
почечная недостаточность, энцефалопатия,
шок. Характерна для тотального некроза
поджелудочной железы, перипанкреатического
некроза с распространением вокруг
железы.
Нарушения
водного и электролитного баланса. Потери
воды и электролитов при остром панкреатите
происходят за счет рвоты, депонирования
в тканях и полостях, паралитической
непроходимости, постоянного истечения
и аспирации желудочного сока. Выпоты в
брюшную и плевральную полости, отечная
жидкость в парапанкреатическом и
ретропанкреатическом пространствах
содержат большое количество белка.
Уже
в первые часы заболевания ОЦК снижается
на 15—20 %, преимущественно за счет
плазматического объема. Дефицит объема
плазмы может достигать 40—50 %, общий
дефицит белков плазмы достигает 50—60
г. Альбумин-глобулиновый коэффициент
смещается в сторону глобулинов.
Гипопротеинемия и особенно гипоальбуминемия
обусловливают снижение КОД плазмы и
усугубляют сдвиги КОС.
Вследствие
потерь плазмы возрастают уровень
гематокрита и вязкость крови. При
геморрагическом панкреатите и
кровотечениях возможна олигоцитемическая
форма гиповолемии, при которой уменьшен
не только объем плазмы, но и глобулярный
объем.
По
мере нарастания изменений в поджелудочной
железе уменьшается объем внеклеточного
пространства, повышается вязкость крови
и возникают нарушения в свертывающей
системе вплоть до распространенной
внутрисосудистой гиперкоагуляции и
тромбообразования.
Содержание
натрия и хлоридов при остром панкреатите
уменьшается, особенно при деструктивных
формах. Снижение уровня калия крови
характеризует выраженность паралитической
кишечной непроходимости. Гипокальциемию
выявляют примерно у 25 % больных, но ее
патогенез недостаточно ясен. Изменения
концентрации калия и кальция в крови
приводят к нарушениям сердечной
деятельности и изменениям ЭКГ.
Метаболический алкалоз может развиться
в результате рвоты и постоянной аспирации
кислого желудочного содержимого. При
анаэробном гликолизе, шоке, олигурии и
анурии наблюдается метаболический
ацидоз. Часто определяется гипергликемия,
обусловленная различными причинами, в
том числе уменьшением высвобождения
инсулина. Примерно у 10 % больных
определяется гипербилирубинемия, но
желтуха обычно носит преходящий характер,
и уровень билирубина нормализуется
через 4—7 дней. У 15—20 % больных определяются
гипертриглицеридемия, снижение РаО2.
Интенсивная
терапия.
Активная
консервативная терапия должна быть
начата возможно раньше, т.е. сразу же
при поступлении больного.
Лечение
шока и гиповолемии.
Первоочередной
задачей является лечение острой
гиповолемии и связанной с ней циркуляторной
недостаточности. Для этой цели необходимо
введение раствора альбумина, а также
плазмы, протеина или растворов крахмала
(волекам, HAES-стерил). Переливание крови
показано только при падении гематокрита.
Для улучшения микроциркуляции назначают
низкомолекулярные декстраны (реополиглюкин,
лонгастерил-40), которые предотвращают
развитие гемагглютинации и тромбирования
в поджелудочной железе. Эти препараты
могут предотвратить переход отечной
формы панкреатита в геморрагическую.
Одновременно следует назначать
инфузионные электролитные растворы
(раствор Рингера, лактасол, ионостерил),
при отсутствии гипергликемии переливают
10—20 % раствор глюкозы.
Количественный
и качественный состав инфузионных сред
может варьировать в зависимости от
состояния больного; степени отрицательного
водного баланса, осмотического и
онкотического состояния крови. Лечение
проводят под контролем ЦВД, показателей
гемодинамики и диуреза. При необходимости
стимулируют диурез. Для этого используют
10 % и 20 % растворы маннитола, инфузионные
растворы сорбитола, методику форсированного
диуреза.
Поддерживающая
инфузионная терапия.
Общий объем инфузий в среднем составляет
50 мл на 1 кг массы тела в сутки при скорости
введения 40—60 капель в минуту. При III
степени тяжести общее количество
растворов достигает 5 л и более при
условии форсированного диуреза. Большое
значение в лечении панкреатита придают
осмотическим стабилизаторам (лактасол,
Рингер-лактат, ионостерил), коллоидным
и белковым растворам. При олигурии может
быть использован желатиноль, который
оказывает отчетливое диуретическое
действие. При гипоальбуминемии необходимо
дробное введение 20 % раствора альбумина
(до 200— 400 мл в сутки). Контролем может
служить концентрация альбумина плазмы,
которая должна быть выше 30 г/л, и уровень
КОД плазмы (не ниже 18—20 мм рт.ст.). При
уровне гематокрита ниже 0,30 переливают
эритроцитную массу, поддерживая уровень
гематокрита в пределах 0,30—0,40.
При
метаболическом ацидозе следует установить
его этиологию. Диабетогенный обмен
веществ, гипергликемия и кетоацидоз
служат показаниями к ограничению глюкозы
и гидрокарбоната. Коррекцию нарушений
калиевого баланса проводят по общепринятой
методике. При ОПН и гиперкалиемии
введение калия противопоказано. Кальций
применяют только при гиперкалиемии или
для ликвидации тетанических судорог,
вызванных гипокальциемией, поскольку
кальций угнетает ингибиторы ферментов
и активирует трипсиноген. К растворам
добавляют витамины: аскорбиновую
кислоту, тиамин, пиридоксин. Проводят
гепаринотерапию — по 5000 ЕД гепарина
3—4 раза в сутки.
Форсированный
диурез —
один из простых и распространенных
методов детоксикации организма при
остром панкреатите. Метод особенно
эффективен в ранние сроки заболевания.
Он основан на создании в организме
гипергидратации с последующим усилением
диуреза мочегонными препаратами. Важно
соблюдать определенную последовательность
в лечении:
предварительная
нагрузка растворами Рингера,
гидрокарбоната натрия и др. Общий объем
вводимой жидкости зависит от степени
выраженности гиповолемии и составляет
обычно 1000—1500 мл;введение
15—20 % раствора маннитола из расчета
1—1,5 г сухого вещества на 1 кг тела
больного;введение
растворов электролитов с учетом
ионограмм;введение
до 1500 мл белковых препаратов (плазма,
аминопептид и т.д.).
Создание
функционального покоя поджелудочной
железы:
воздержание
от приема пищи в течение не менее 4—5
дней;воздержание
от приема воды минимум в течение 2—3
дней;постоянная
аспирация желудочного содержимого с
помощью назогастрального зонда. Важно,
чтобы зонд располагался не в антральном
отделе желудка, а по большой его
кривизне, где скапливается содержимое
в положении лежа;локальная
желудочная гипотермия;назначение
антацидных средств (алмагель, алмагель
А) и средств, снижающих желудочное
кислотовыделение, панкреатическую
секрецию.назначение
цитостатиков и антиферментных
препаратов. Многие авторы рекомендуют
при остром панкреатите применение
контрикала, трасилола и других средств.
Этот вопрос является спорным. Активация
трипсина играет наиболее выраженную
роль в начальной стадии заболевания.
Терапия в этом случае всегда запаздывает.
Несмотря на это, большинство авторов
придерживается мнения о необходимости
ингибирующей терапии. Для этого
рекомендуют применять 100 000—300 000 ЕД
контрикала в сутки или 500 000—1,2 млн КИЕ
апротинина в сутки в виде внутривенных
капельных инфузий в течение 4—6 дней,
а затем уменьшая дозы в зависимости
от течения заболевания. Клиническое
улучшение при назначении контрикала
и трасилола связывают с их антиферментным
действием, стабилизирующим влиянием
на сердечно-сосудистую систему и
обезболивающим эффектом.
Парентеральное
питание.
Назначение стандартных растворов для
инфузионной терапии недостаточно для
обеспечения больного необходимым
количеством калорий и белка. Парентеральное
питание не стимулирует панкреатическую
секрецию, поэтому является важной
составной частью лечения панкреатита.
Парентеральное питание необходимо
начинать сразу же после ликвидации
острых водно-электролитных нарушений
и шока. Общее количество калорий должно
составлять 2000—3000 ккал/сут. Жировые
эмульсии как основной источник энергии
при остром панкреатите противопоказаны,
поскольку усиливают воспаление
поджелудочной железы.
Обезболивание. В
настоящее время стандартом обезболивания
при остром панкреатите является
постановка эпидурального катетера на
уровне Th6-Th10 с последующим введением
0,25% раствора наропина со скоростью 4-6
мл/час. Кроме обезболивающего эффекта
эпидуральное обезболивание обладает
прокинетеческим бействием т.е. стимулирует
моторику желудочно-кишечного тракта.
Перитонеальный
лаваж и лапаротомия. Удаление токсического
экссудата из брюшной полости снижает
явления токсемии. С этой целью проводят
либо перитонеальный лаваж, либо
лапаротомию с дренированием.
Антибактериальная
терапия.
Раннее назначение антибиотиков, как
правило, неэффективно. Антибиотики
показаны в случаях вторичной инфекции
некротизированной ткани поджелудочной
железы или обтурированных желчных
протоков. Течение болезни во многом
определяется факторами, снижающими
уровень выживаемости при остром
панкреатите. К ним относятся пожилой
возраст, гипотензия, шок, значительные
водно-электролитные нарушения,
гипергликемия, гипокальциемия или
гиперкальциемия. Наибольшее значение
имеют три
фактора, которые отягощают прогноз:
дыхательная
недостаточность, требующая интубации
и ИВЛ;шок;
уровень
кальция в сыворотке крови выше 80 мг/л.
Осложнения
острого панкреатита:
легочные
(плевральный выпот, ателектаз,
медиастинальный абсцесс, пневмония,
РДСВ);сердечно-сосудистые
(гипотензия, гиповолемия, перикардит,
гипоальбуминемия, внезапная смерть);гематологические
(ДВС-синдром, желудочное кровотечение,
тромбозы воротной вены);почечные
(олигурия, азотемия, тромбоз почечной
артерии);метаболические
(гипергликемия, гипертриглицеридемия,
гипокальциемия, энцефалопатия, психоз,
жировая эмболия, жировой некроз и др.).
Общая
схема лечения:
диета
— голодание в течение 4 сут, затем
сухари, отвары, каши и строго обезжиренная
пища;парентеральное
питание с первых же дней лечения после
ликвидации шока, выраженных
гемодинамических, водно-электролитных
нарушений и почечной недостаточности;промывание
желудка проводится не менее 4 сут;лечение
шока обычно заканчивается к концу
1—2-х или 3-х суток. Главное в лечении
шока — введение альбумина и других
плазмозамещающих растворов;коррекция
водно-электролитного баланса и КОС
проводится в течение всего периода
активного лечения — примерно 7 дней
от поступления больного;трансфузии
эритроцитной массы или крови, переливание
альбумина, плазмы осуществляют по
показаниям в течение всего времени
лечения;активная
стимуляция диуреза — в течение первых
3 дней лечения;контрикал
назначают в течение 15 дней.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник