Острый панкреатит как проблема ургентной хирургии и интенсивной терапии
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Салиенко С.В.
1
Салиенко Е.В.
1
Мамонтова Е.В.
2
1 ФГБУЗ «Медико-санитарная часть №98 ФМБА России»
2 ГОУ ВПО «Астраханский государственный университет»
Основной причиной летальных исходов при остром деструктивном панкреатите в настоящее время являются гнойно-септические осложнения. Будучи инфицирован гнойно – гнилостными микроорганизмами, некротический процесс склонен распространятся на отдаленные от своего источника отделы. Этому могут способствовать агрессивные свойства гноя, содержащего большое количество панкреатических ферментов и анатомические особенности забрюшинного пространства, допускающие сообщения между теми или иными его отделами. Описаны основные закономерности локализации абсцессов при гнойных осложнениях деструктивного панкреатита. Проанализированы результаты лечения 27 больных с развившимся гнойным оментобурситом. 26 пациентов оперированы открытым способом, одному выполнено дренирование сальниковой сумки под сонографическим контролем. Послеоперационная летальность составила 7,7% (2 больных). Авторы делают выводы об абсолютной необходимости активной хирургической тактики при установлении диагноза и многократном характере санационных вмешательств.
деструктивный панкреатит; гнойный оментобурсит; хирургическое лечение
1. Боженков Ю.Г., Щербюк А.Н., Шалин С.А. Практическая панкреатология – Н.Новгород, 2003 – 208 с.
2. Бубнова Н.А., Акинчиц Л.Г., Чаленко В.В., Петров С.В., Бояркин Г.М., Маслевцов Д.В. Современные особенности хирургического сепсиса. // Матер. научно-практ. конф. «Гнойные заболевания и инфекционные осложнения в хирургии»– СПб – 1997 – с. 42-43.
3. Даценко Б.М., Мартыненко А.П., Гальперин М.Л.и др. Клинико-морфологические подходы к выбору лечебной тактики при остром панкреатите //Актуальные вопросы хирургии поджелудочной железы: Тез. докл. Всесоюз. науч. конф. – Киев – 1988. — С. 20 — 21.
4. Костырной А.В. Тактика хирурга при гнойно-некротических осложнениях острого панкреатита // Клінічна хірургія. — 2000. — № 5. — С. 57-58.
5. Рудаков А.А., Дуберман Б.Д. Панкреатическая инфекция // Анналы хирургической гепатологии. — 1998. — Т. 3, № 2. — С. 94-99.
6. Савельев В.С., Филимонов М.И., Гельфанд Б.Р.и др. Острый панкреатит как проблема ургентной хирургии и интенсивной терапии [электронный ресурс]/ URL: https://www.consilium-medicum.com/medicum/article/11857/ (дата обращения 29.11.2012)
7. Савельев В.С., Гельфанд Б.Р., Гологорский В.А., Филимонов М.И., Бурневич С.З. Деструктивный панкреатит в свете современных представлений о сепсисе. — Анналы хирургии –М. 1999 – 5 – с. 26-9.
8. Buchler M.W., Gloor B., Muller C.A., Friess H., Seiler C.A., Uhl W. Acute necrotizing pancreatitis: treatment strategy according to the status of infection/ Ann. Surg. — 2000. — № 5. — Р. 619 — 626.
9. Rattner D.W., Legermate D.A., Lee M.J. et al. Early surgical debridement of symptomatic pancreatic necrosis is benefical irrespective of infection / Am J Surg – 1992 — 163(1) – р. 105-10.
Основной причиной летальных исходов при остром деструктивном панкреатите в настоящее время являются гнойно-септические осложнения. Будучи инфицирован гнойно – гнилостными микроорганизмами, некротический процесс склонен распространятся на отдаленные от своего источника отделы. Этому могут способствовать агрессивные свойства гноя, содержащего большое количество панкреатических ферментов и анатомические особенности забрюшинного пространства, допускающие сообщения между теми или иными его отделами. Развитие осложнений происходит, как правило, per continuitatem, путем расплавления брюшинного листка, отделяющего забрюшинно располагающуюся поджелудочную железу от свободной брюшной полости [1,2,5]. Исследование по лечению и применению хирургического вмешательства при гнойном оментобурсите является актуальной задачей.
Целью работы является рассмотрение проблемы диагностики и хирургической тактики при наиболее часто встречающемся гнойном осложнении деструктивного панкреатита – оментобурсите.
К сожалению, до сих пор не выработано четких единых рекомендаций относительно способов хирургического лечения гнойного оментобурсита (за исключением нескольких региональных стандартов)[6,7,8]. Практически ежегодно проблемы лечения осложнений деструктивного панкреатита обсуждаются на многочисленных конференциях и съездах, однако на настоящий момент летальность при инфицированном панкреонекрозе составляет до 70%[4,5,7]. Открытыми остаются вопросы относительно места малоинвазивных методик (пункционные методы и дренирование) в арсенале лечащего врача, сроки выполнения, показания и противопоказания к оперативным вмешательствам[4]. Проблема усугубляется тем, что рекомендуемые в литературных источниках современные методы инструментальной (МРТ, спиральная КТ, тонкоигольная пункция-аспирация под УЗ-контролем) и лабораторной (прокальцитониновый тест) диагностики практически недоступны на уровне хирургических отделений районных и небольших городских больниц.
За период 2007-2011 гг. в хирургическом отделении ФГУЗ МСЧ №98 проведено лечение 37 больных деструктивным панкреатитом, в течение заболевания которых зарегистрированы гнойно-септические осложнения. При разборе хирургической анатомии присоединившихся осложнений выявлено следующее. Разрушение заднего листка брюшины над поджелудочной железой и проникновение гноя в сальниковую сумку вызывает гнойный оментобурсит (центральная локализация – 27 больных, 72,9%). Прорыв гноя через винслово отверстие приводит к образованию подпеченочного или правостороннего гнойника (6 пациентов – 16,3%), разрушение левых отделов mesocolon и желудочно-ободочной связки – к образованию левостороннего поддиафрагмального абсцесса (у 2 больных – 5,4%). Под тотальной локализацией имелось в виду абсцедирование обширных участков некроза парапанкреатической и параколярной клетчатки как по ходу восходящей, так и по ходу нисходящей ободочной кишки (2 человека – 5,4%). Области локализации панкреатогенных абсцессов приведены на рисунке 1. Проведен анализ историй болезни 27 пациентов, у которых течение деструктивного панкреатита осложнилось присоединением гнойного оментобурсита (в качестве единственного первичного гнойного очага).
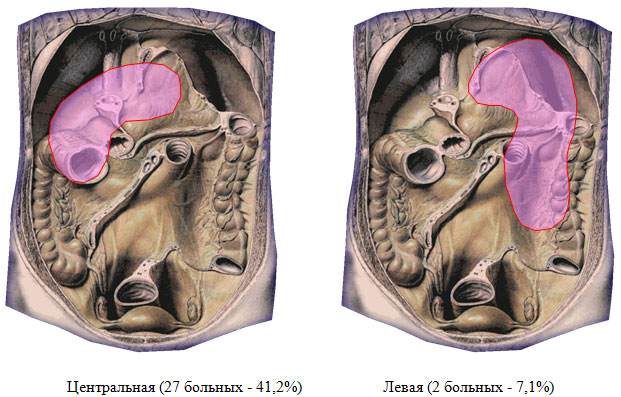
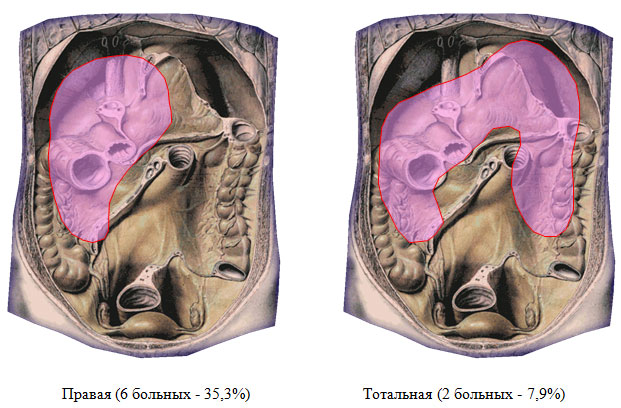
Рисунок 1. Локализация панкреатогенных абсцессов
Возраст больных составил 17- 55 лет. Мужчин было 19 человек (70,4%), женщин – 8 (29,6%). Состав больных разделённых по возрастам приведён на рисунке 2.
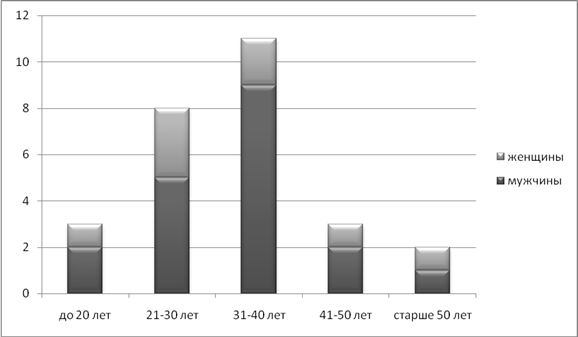
Рисунок 2. Состав больных по полу и возрасту
Установление наличия гнойного осложнения базировалось на характерной клинической картине, данных инструментального исследования (УЗИ, КТ) и лабораторных тестах (определение активности панкреатических ферментов, прокальцитониновый тест) и являлось безусловным показанием к активной хирургической тактике.
Часть исследованных больных (26 человек) подверглись оперативному лечению, выполненному на 10-15 сутки от момента начала заболевания, 3 пациентам после предварительно выполненной компьютерной томографии было произведено эхоконтролируемое дренирование сальниковой сумки. Из числа больных последней группы у 2 человек манипуляция не дала положительного результата и они были оперированы традиционным способом через 3 суток после первичного дренирования. У всех больных операция выполнялась полуоткрытым способом, предусматривающим установку трубчатых дренажей вместе с тампоном Penrose. В послеоперационном периоде больным проводилась интенсивная инфузионно-трансфузионная, антибактериальная, антисекреторная, симптоматическая терапия.
Присоединение при деструктивном панкреатите гнойно-септических осложнений является абсолютным показанием к оперативному вмешательству. Этот факт в настоящее время не вызывает сомнений, т.к. дальнейшее консервативное ведение больных с несанированными гнойными очагами бесперспективно и ведет к неблагоприятному исходу [4,9].
Сроки оперативных вмешательств, диктовавшихся установлением диагноза гнойного оментобурсита, приведены на рисунке 3. Подавляющее число пациентов (21 человек) были оперированы в конце второй – начале третьей недели заболевания (12-18 сут.), что согласуется с литературными данными [1,5], 4 больных – в период 19-25 сутки и один — на на 10-е сутки.
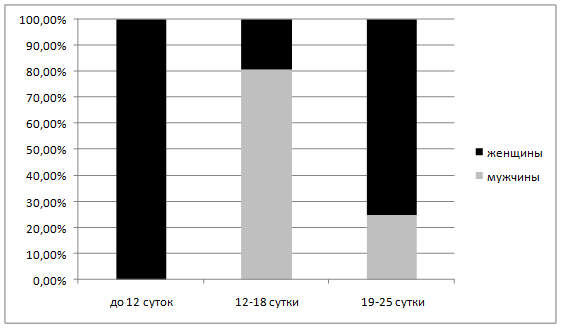
Рисунок 3. Сроки оперативных вмешательств у больных с гнойным оментобурситом.
Полуоткрытый тип операций у больных с гнойным оментобурситом, завершающийся формированием оментобурсостомы предусматривает возможность многократных некр- и секвестрэктомий без риска подвергать больного повторной (пусть даже запрограммированной) лапаротомии, на что указывает большое количество авторов [3,4,5,7,9]. Однократная некрозосеквестрэктомия, как правило, не несет радикального характера и возникает необходимость в повторных санациях сальниковой сумки. В исследуемой группе однократная санация проведена у 2 (7%) человек, двухкратно – у 6 (22%), трехкратно – у 14(52%), четырехкратно – у 5 (19%) пациентов (рисунок 4).
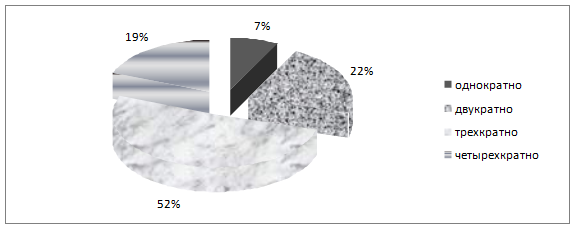
Рисунок 4. Кратность некрсеквестрэктомий у больных с гнойным оментобурситом
Благоприятный исход лечения достигнут у 23 больных (88,5%). Смерть 2 пациентов (7,7%) связана с развитием полиорганной недостаточности на фоне прогрессирования гнойных осложнений, одной (3,8%) – с развитием аррозивного кровотечения из брюшного отдела аорты.
Отдельно следует выделить группу из 3 больных, у которых была предпринята попытка дренирования жидкостного образования под УЗ-контролем. Во всех трех случаях попытка увенчалась успехом и сальниковая сумка была санирована через установленные дренажи. Однако в последующем течение заболевания у 2 пациентов, сопровождающееся длительным выделением гнойного экссудата (более 7-10 дней) и его объемом (более 100 мл/сут), несмотря на ежедневные санации растворами антисептиков и консервативную терапию, заставило заподозрить наличие секвестрированных очагов некроза, поддерживающих воспалительный процесс. Это было установлено при повторной КТ и больные были оперированы стандартным полуоткрытым способом.
В ходе проведённых исследований получены следующие результаты:
- Гнойный оментобурсит, представляет собой острое жидкостное образование, формирующееся в результате разрушения заднего листка брюшины над пораженной поджелудочной железой с последующим инфицированием (т.е. абсцесс).
- Являясь наиболее часто встречающимся вариантом гнойно-септических осложнений деструктивного панкреатита, оментобурсит характеризуется отсутствием четких единых методических подходов к диагностике и хирургической тактике.
- Диагноз гнойного оментобурсита служит абсолютным показанием к активной хирургической тактике, заключающейся в различных вариантах санирующих вмешательств.
Работа выполнена в рамках Федеральной целевой программы ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы.
Рецензенты:
Сарвилина Ирина Владиславовна, д.м.н., ген. директор медицинского центра «Новомедицина», ведущий научный сотрудник ЗАО НПО «Европа-Биофарм», г. Ростов-на-Дону.
Масляков Юрий Степанович, д.м.н., профессор, зав. кафедрой «Фармокология и клиническая формакология» ГБОУ ВПО «РостГМУ» Минздрава России, г. Ростов-на-Дону.
Библиографическая ссылка
Салиенко С.В., Салиенко Е.В., Мамонтова Е.В. ГНОЙНЫЙ ОМЕНТОБУРСИТ КАК ОСЛОЖНЕНИЕ ДЕСТРУКТИВНОГО ПАНКРЕАТИТА // Современные проблемы науки и образования. – 2012. – № 6.;
URL: https://science-education.ru/ru/article/view?id=7824 (дата обращения: 26.10.2019).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Некротизирующий панкреатит (НП), как клинико–морфологическая форма острого воспаления поджелудочной железы, может осложняться развитием целого комплекса жизнеугрожающих патологических синдромов: шок, острый респираторный дистресс–синдром, острая почечная недостаточность и другие. С позиций этиопатогенеза инфицированный панкреонекроз рассматривается в качестве варианта абдоминального сепсиса [1,3–4]. Тяжесть органно–системных расстройств и необходимость использования в процессе терапии инвазивных технологий повышают риск присоединения госпитальных инфекций различной локализации, которые нередко определяют прогноз исхода болезни. В этих условиях летальность при НП, как правило, превышает 20–30% [1–5]. Неудивительно, что наряду с вопросами диагностики и хирургической тактики продолжает активно обсуждаться проблема интенсивной терапии. Подтверждением тому является выход в последнее время ряда рекомендательных документов под эгидой обществ различных медицинских специальностей: Американского колледжа гастроэнтерологов; Международной панкреатологической ассоциации; Международной согласительной конференции Американского торакального общества, Европейского Общества интенсивной терапии, Интернационального Общества медицины критических состояний; UK guidelines for management of acute pancreatitis [3–5].
Цель настоящей публикации – анализ существующих рекомендаций и современной научной базы данных по ключевым вопросам интенсивной терапии НП.
Показания для госпитализации
в ОРИТ
Специфических критериев для госпитализации в ОРИТ пациентов с НП не установлено. Поэтому для принятия решения рекомендуется ориентироваться на наличие предикторов тяжелого течения заболевания [3] (табл. 1).
Наряду с перечисленным особое внимание следует уделять пожилым, а также пациентам с большим объемом панкреонекроза – более 30%.
Принципиально важно, чтобы на реанимационном этапе была возможность выполнения компьютерной томографии, эндоскопических исследований и хирургических вмешательств под радиологическим контролем, а также обеспечения адекватного обезболивания пациентов, в том числе посредством продленной эпидуральной инфузии местных анестетиков (например, Наропина).
Коррекция
гемодинамических нарушений
Инфузионно–трансфузионная терапия обеспечивает решение нескольких задач: восстановление адекватной тканевой и органной перфузии, нормализация и поддержание кислородного транспорта (ТО2), повышение потребления кислорода (ПО2) тканями, коррекция гомеостатических расстройств и ограничение системной воспалительной реакции.
Раннее начало инфузионной терапии будет в определенной мере способствовать предупреждению или более быстрому разрешению органно–системной дисфункции.
С позиций патогенеза органных расстройств при НП можно сформулировать ряд требований к оптимальным инфузионным средам: способность повышать коллоидно–осмотическое давление, минимальный риск «утечки» в интерстиций, длительный волемический эффект, снижение содержания молекул адгезии, управляемый реологический эффект, повышение потребления кислорода, инертность в отношении лекарственных средств.
В этом отношении в последнее время наиболее хорошую аттестацию получили растворы гидроксиэтилкрахмалов (ГЭК). Полезной для всех клинических ситуаций, включая ПН, сопровождающихся формированием СВР, является способность ГЭК ограничивать секрецию провоспалительных цитокинов циркулирующими макрофагами и адгезивных молекул эндотелием. Наибольшее количество подобных доказательств получено для ГЭК – 130/0,4 и 200/0,5 [13–15,23].
Для НП, как и для других вариантов сепсиса, характерно наличие миокардиальной дисфункции, относительной гиповолемии, неравномерного распределения объема циркулирующей крови, повышения капиллярной проницаемости, частое развитие коагулопатии потребления. В этих условиях избыточное повышение гидростатического давления в легочных капиллярах и ограничение лимфодренажа, сопровождаются при проведении ИТТ накоплением воды в экстраваскулярном секторе.
Чрезвычайная сложность, многообразие и неоднородность морфологических и функциональных нарушений гомеостаза не позволяет предложить однозначной и четко очерченной схемы инфузионно–трансфузионной терапии для всех пациентов. С позиций сегодняшних знаний мы вправе говорить лишь о ее основополагающих принципах [1]:
– Схема ИТТ может включать в себя сочетания различных искусственных (кристаллоиды, коллоиды) инфузионных сред, крови или ее компонентов, альбумина. Ее реальное содержание определяется клинико–лабораторной ситуацией у конкретного больного на данный момент времени.
– Для оптимального выбора объема и содержания ИТТ необходим мониторинг PaO2/FiO2, параметров кислородного транспорта, концентрации альбумина, коллоидно–осмотического давления, осмолярности плазмы, гематокрита, уровня гемоглобина, центральной гемодинамики (МОС, ЦВД, САД, Рзакл.), показателей системы гемостаза (ПТИ, фибриноген, тромбоциты и АЧТВ), не говоря уже о важности измерения ряда рутинных показателей, не требующих обсуждения (диурез, электролиты и др.). Отсутствие возможности мониторинга какого–либо из перечисленных показателей затрудняет правильный выбор терапии и повышает риск развития ятрогенных осложнений.
Респираторная
поддержка
Течение НП может осложниться развитием синдрома острого легочного повреждения (СОЛП) или острым респираторным дистресс–синдромом (ОРДС). Показания к проведению ИВЛ определяются степенью тяжести дыхательной недостаточности: при снижении респираторного индекса ниже 200 показаны интубация трахеи и проведение ИВЛ. При респираторном индексе выше 200 показания определяются в индивидуальном порядке. Наличие адекватного сознания, отсутствие высоких затрат на работу дыхания, выраженной тахикардии (ЧСС до 120 в минуту), нормализация венозного возврата крови и SpO2 > 90% на фоне кислородной поддержки спонтанного дыхания вполне позволяет воздержаться от перевода на ИВЛ, но не от строгого контроля за динамикой состояния больного. Оптимальный уровень насыщения крови кислородом (~90%) можно поддерживать с помощью различных методов кислородотерапии (лицевые маски, носовые катетеры) при использовании нетоксичной концентрации кислорода (FiO2
Роль антибактериальных
препаратов при НП
Профилактика локальных
и системных инфекционных осложнений
Как показывает проведенный нами анализ, позиции специалистов уже не столь однозначны и дискуссии по поводу назначения АБП с профилактической целью при НП в последнее время усилились.
Изначально использование антибактериальных препаратов (АБП) при НП получило поддержку большинства клиницистов, поскольку около 80% летальных исходов связано с инфицированным некрозом, а «окно времени» для возникновения инфекции делает ее предупреждение потенциально достижимой. Проведенная затем серия из 4–х проспективных контролируемых исследований (КИ) и их последующее объединение в мета–анализ подтвердили верность априорного предположения [6–9]. Эти кумулятивные данные показали снижение риска локальных инфекций, связанных с поджелудочной железой на 14% (р=0,04); сепсиса на 25% (р=0,0002) и смертности – на 13% (р=0,007) [10].
Основные аргументы оппонентов, выступающих за ограничение профилактического использования АБП, сводятся к возможности минимизации развития резистентности, суперинфекций и денежных затрат. Они также обращают внимание на отсутствие двойного слепого контроля и на относительно небольшое количество пациентов, включенных в исследования. Действительно, в наиболее хорошо организованном из обозначенной серии исследовании не было доказано снижение частоты развития органной дисфункции и смертности, авторы лишь зафиксировали на фоне профилактического назначения карбапенема уменьшение количества положительных бактериологических культур из ткани pancreas, полученных c помощью тонкоигольной биопсии [1]. В дальнейшем Insenmann et al. [11] продемонстрировали существенное увеличение числа случаев кандидозной инфекции у пациентов с панкреонекрозом, получавших антибиотики по данному показанию. Среди 92 больных с инфицированным НП у 22–х развилась кандидозная инфекция с летальностью 64% против 19% (p
Что же сегодня является оптимальным выбором для повседневной клинической практики?
Оставаясь принципиальными сторонниками ограничительной политики по использованию АБП в ОРИТ, нам представляется более оправданной практика их назначения по аргументированным клиническим показаниям. Применительно к НП они могут быть взяты из выполненного на высоком уровне в методологическом отношении плацебо–контролируемого исследования Berg и соавт. [19], получивших доказательства сравнимых клинических исходов (выживаемость, число системных осложнений, продолжительность госпитализации) как в случае облигатного назначения всем больным при установлении диагноза ципрофлоксацина в сочетании с метронидазолом, так и при их использовании по определенным показаниям: развитие инфекционных осложнений, появление СВР или ПОН. Ориентация исключительно на результаты КТ–управляемой аспирации не представляется возможной в широкой практике из–за отсутствия надлежащей технической оснащенности в большинстве ЛПУ, катастрофически малого количества микробиологических лабораторий, работающих по современным международным стандартам и риска получения ложно–отрицательных результатов по причине технологических погрешностей. В связи с отсутствием убедительных доказательств преимущества какой–либо схемы АБП, подход к ее выбору должен быть основан на знании этиологической структуры и фармакокинетических характеристик антибиотиков. В целом приемлемые варианты сходны с таковыми при интраабдоминальных инфекциях, обусловленных другими причинами: цефалоспорины 2–4–й генерации или фторхинолоны + метронидазол; ингибитор–защищенные пенициллины +/– аминогликозиды; карбапенемы.
Интересны и результаты рандомизированного контролируемого сравнительного исследования эффективности меропенема и имипенема [24]. В группах пациентов, получавших меропенем по 0,5х3 раза/сут. или имипенем в дозе 0,5х4 раза/сут, частота развития экстра– и панкреатической инфекции была одинаковой, т.е. меропенем в суточной дозе 1,5 г продемонстрировал такую же эффективность в профилактике септических осложнений при тяжелом остром панкреатите, что и имипенем в дозе 2,0 г.
Терапия инфекционных
осложнений
Инфекционные осложнения со стороны забрюшинного пространства и брюшной полости при НП, развившиеся в ОРИТ в процессе интенсивной терапии и требующие хирургического вмешательства, по определению попадают в разряд нозокомиальных. Практически всегда они возникают на фоне системного применения АБП широкого спектра действия или их комбинаций. В этих условиях высока вероятность обнаружить в качестве возбудителей микроорганизмы с множественной устойчивостью к антибиотикам: Е. сoli и К. pneumoniae – продуценты БЛРС, неферментирующие бактерии, MRSA, Еnterococcus faeceum.
Последующая за оперативным вмешательством тактика АБТ, с нашей точки зрения, определяется прежде всего применяемой на момент возникновения осложнения схемой АБП и тяжестью состояния.
При достаточно стабильном состоянии на момент возникновения показаний для оперативного вмешательства (нет прогрессирования СВР, органной дисфункции) и использовании карбапенемов (меропенем, имипенем/циластатин) или цефепима нет необходимости смены препаратов до получения результатов бактериологического исследования.
В случае нарастания проявлений СВР в сочетании с утяжелением полиорганного синдрома, в особенности на фоне длительного введения цефалоспоринов 2–3–й генерации или фторхинолонов, следует сделать акцент на препараты с более высокой активностью в отношении обозначенных выше возбудителей ГИ (включая грампозитивные бактерии), не дожидаясь микробиологических аргументов.
Кроме того, оправдана смена режимов дозирования карбапенемов – приоритет инфузионному пути введения. Так, при увеличении времени введения меропенема (Меронем) (0,5х3 р/сут.) от 30 минут до 3–х часов время превышения МПК в отношении P. aeruginosa повышается с 72,5% до 87,9%, а в случае разовой дозы 1,0 – с 82,5% до 92,4%. Близкие фармакокинетические параметры получены и при 4–кратном введении препарата в разовой дозе 500 мг [17–18]. Экономические и клинические преимущества такого подхода для практики вполне очевидны.
Между тем в ситуации инфицированного НП, когда зачастую невозможна одномоментная санация очага и требуется выполнение этапных некросеквестрэктомий, не следует переоценивать эффект от АБП. Динамический контроль за течением локального инфекционного процесса и своевременная адекватная хирургическая санация имеют, вне всякого сомнения, приоритетное значение.
Фармакологическая блокада
экзокринной секреции
Оптимизм, вызванный результатами ранних работ по использованию синтетических аналогов соматостатина, в настоящее время заметно поубавился: последующие исследования посеяли серьезные сомнения в отношении необходимости их применения [20–21]. Одно из последних хорошо организованных исследований, выполненное немецкой рабочей группой по изучению панкреатита, не показало какой–либо целесообразности включения октреотида в комплекс терапии НП [22]. В итоге данное направление терапии не вошло в последние согласительные документы по острому панкреатиту [3–5].
Нутритивная поддержка
НП, как правило, сопровождается проявлениями гиперметаболизма. В этой ситуации покрытие энергетических потребностей происходит за счет деструкции собственных клеточных структур, что усугубляет органно–системную дисфункцию. Нутритивная поддержка рассматривается в качестве метода, предотвращающего развитие тяжелого истощения. Эксперты пяти международных медицинских ассоциаций формулируют следующие принципы ее проведения [12]:
– Отдавать предпочтение энтеральному питанию (ЭП) перед парентеральным. По возможности ЭП должно осуществляться через зонд, проведенный в тонкий кишечник.
• Парентеральное питание назначают, если не могут в течение 5–7 дней наладить ЭП.
• При назначении ПП целесообразно использовать среды, обогащенные глутамином.
• Контроль уровня глюкозы в крови в пределах 4,4–6,1 ммоль/л.
• Смеси, содержащие в своем составе иммуномодуляторы и пробиотики для рутинного использования, не рекомендуются.
Заключение
Специфических подходов в лечении панкреонекроза к настоящему времени не существует. Улучшение результатов при этом заболевании может быть достигнуто за счет стратификации больных по риску осложнений, внедрения современных методов диагностики, ранней, адекватной хирургической санации очагов инфекции и реализации современных протоколов поддерживающей терапии. При инфицированном панкреонекрозе необходимо придерживаться существующих рекомендаций интенсивной терапии абдоминального сепсиса.
Литература
1. Сепсис в начале ХХI века. Классификация, клинико–диагностическая концепция и лечение. Патолого–анатомическая диагностика: Практическое руководство., М.:Издатаельчство НЦССХ им. А.Н. Бакулева РАМН, 2004,130с.
2. Гельфанд Б.Р., Филимонов М.И., Бурневич С.З. и др. Оценка эффективности различных режимов профилактики и терапии при панкреонекрозе. Consilium medicum.Приложение. 2001: 12–14.
3. UK guidelines for management of acute pancreatitis. Gut 2005; 54:1–9.
4. JAP guidelines for surgical management of acute pancreatitis. Pancreatology 2002;2:565–573.
5. Bancs PA. Practice guidelines in acute pancreatitis. Am J Gastroenterol 1997; 92:377–386.
6. Pederzoli P., Bassi C., Vesentini S. et al. A randomized multicenter clinical trial of antibiotic prophylactics of septic complications in acute necrotizing pancreatitis with imipenem. Surg Gynecol Obstet 1993; 176: 480 – 483.
7. Sanio V., kempainen E., Puolakkinen P. et al. Early antibiotic treatment in acute necrotizing pancretitis.Lancet 1995;346:663–667.
8. Delcenserie R.,Yzet T.,Ducroix JP. Et al. Prophylactic antibiotics in treatment of severe acute alcoholic pancreatitis. Pancreas 1996;13:198–201.
9. Schwarz M., Isenmann R., Meyer H. et al. Antibiotic use in necrotizing pancreatitis.Results of controllrd study. Dtsch Med Wochenscher 1997;12:356–361.
10. Bosscha K.,Vos A.,Visser M. et al. Reduced risk of complications associated with severe acute pancretitis by administration of antibiotics; results from a literature review. Ned Tijdschr Geneesked 2001;145:1982–1985.
11. Insenmann R.,Schwarz M.,Rau B. et al. Characteristics of infection with candida species in patients with necrotizing pancreatitis. World J Surg 2002;25:
12. Nathens A.B.,Curtis J.,Beal R. et al. Management of critically ill patient with severe acute pancretitis. Crit Care Med 2004; 32:2524–2536.
13. Chanand J., Ayala A., Chaudry H.Influence of hydroxyethystarch on inflammatory cytokine release following trauma and hemorrhagic shock. Intensive Care Med 1994(S1); 20:A325
14. Boldt J., Muller M., Heensen M. Influence of different volume therapies and pentoxifylline infusion on circulating soluble adhesion molecules in critically ill patients. Crit Care Med 1996; 24:385–391
15. Dietrich H., Nohe B., Rothmund M. Influence different colloids on the expression of endothelial cell adhesion molecules. Chock 1997;7:A197
16. 1.Rivers E.,Nguyen B.,Havstad S. et al. Early goal–directed therapy in the treatment severe sepsis and septic shock. N Engl J Med 2001;345:1368–1377.
17. Drusano G.L. Prevrntion of resistance: a goal for dose selection of antimicrobials agents. Clin Infect Dis 2003; 36:42–52.
18. Kuti JL, DandekarPK, Nightingale C.. Use Monte Carlo Simulation to design an optimized pharmacodynamic dosing. J Clin Pharmacol 2003;43:1116–1123.
19. Berger U. Antibiotics prophylactics in severe acute pancreatitis may not improve outcomes. Garoenterology 2004;127:997–1004.
20. Gjorup I.,RoikjaerO.,Andersen B. et al. A double–blinded multicenter trial of somatostatin in the treatment of acute pancreatitis. Surg Gynecol Obstet 1992; 175:397 – 400.
21. McCay C., BaxterJ., Imrie C. A randomized controlled trial of octreotid in management of patients with acute pancreatitis. Int J Pancreatol 1997; 21:13–19.
22. Uhl W., Buchler M., Malfertheine P.et al. Randomized double blind multicenter trial of somatostatin in moderate to severe acute pancreatitis. Gut 1999;45:97–104.
23. Hoffmann J.N. et al. HES –130/0.4 but not crystalloid volume support improve microcirculation duaring normotesive endotexemia. Anaesthesioligy 2002; 57:463–470.
24. Gianpiero Manes et al. Prophylaxis with Meropenem of Septic Complications in Acute Pancreatitis: A Randomized, Controlled Trial Versus Imipenem. Pancreas Х Volume 27, Number 4, November 2003; 79–83.
Источник
