Эндоскопическая папиллотомия при панкреатите
Редакция: 12.06.2018
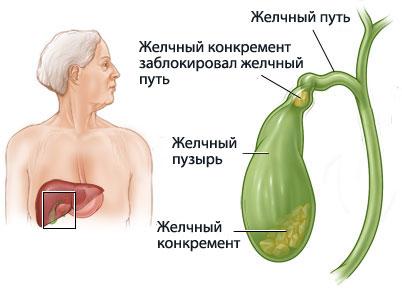
Эндоскопическая папиллосфинктеротомия (ЭПСТ) – оперативное малоинвазивное вмешательство, которое проводится при наличии патологии большого сосочка двенадцатиперстной кишки, а также при закупоривании желчных протоков камнями. При этой бескровной процедуре позитивный результат достигается более чем в 90% случаев.
Процесс эндоскопической папиллосфинктеротомии
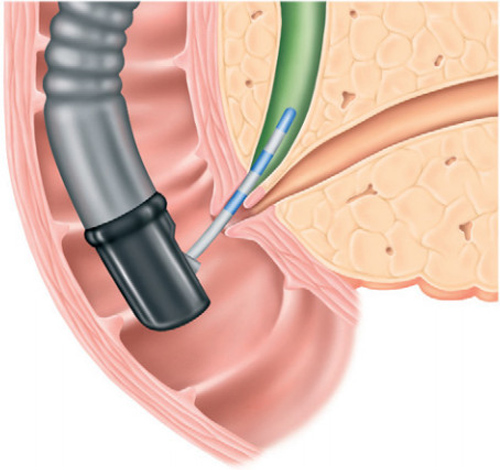
Перед операцией больной обязательно должен сдать анализ крови, чтоб проверить время ее свертываемости, количество тромбоцитов и уровень гемоглобина. Если коагуляция крови нарушена – процедура проводиться не может. Поскольку операция проводится только с применением местной анестезии, то предварительно больному вводятся успокоительные препараты, после чего он ложится на левый бок, раствором лидокаина обезболивается полость рта и глотки. Это необходимо, чтоб ввести пациенту дуоденоскоп в двенадцатиперстную кишку, который снабжен оптическими приспособлениями и помогает найти и обследовать фатеров сосок.
Осмотр позволяет определить наличие папиллостеноза, то есть патологию сосочка, и установить его причины: рубцы, отек, аденома или гиперплазия. Через канал эндоскопа протягивается специальный зонд с канюлей на конце, которую врач проталкивает в устье фатерова соска в желчные, чтоб ввести рентгеноконтрастное вещество. Этот процесс называется ретроградной холангиопанкреатографией и являет собой метод, комбинирующий эндоскопию и рентгенологию. Такое исследование помогает обнаружить конкременты, их количество и размеры, оценивается состояние протока в целом.
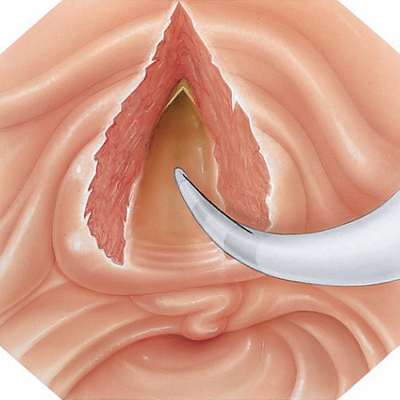
Только после всех этих манипуляций начинается собственно процесс эндоскопической папиллосфинктеротомии. В фатеров сосочек устанавливают специальный инструмент, который называется сфинктеротомом или папиллотомом. Существует более десяти их конструкций, но суть одна: основной их частью является изогнутая и напоминающая тетиву проволока, по которой для спаивания тканей и предотвращения кровотечения проходит ток.
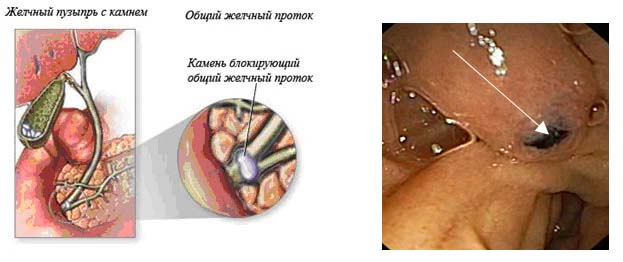
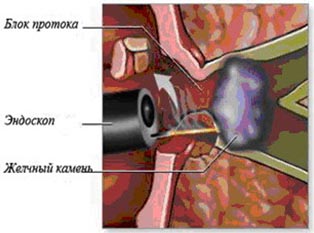
Одним из последствий патологии большого дуоденального сосочка является холедохолитиаз, то есть наличие в желчных протоках камней. Поэтому одновременно с папиллостенозом больному устраняют и второй недуг. При небольших размерах конкременты могут выходить самостоятельно, в противном случае понадобятся корзинки Дормиа и баллонные катетеры.
Захваты камней следует обязательно делать при рентгенологическом контроле, поскольку иначе может произойти попадание в корзину двух и более конкрементов и их застревание в папиллотомном разрезе. Вводить корзины Дормиа можно до тех пор, пока все камни не будут извлечены.
Показания для процедуры
Как мы уже говорили, в основном эндоскопическая папиллосфинктеротомия назначается больным стенозом фатерова сосочка и холедохолитиазом, что является причиной-следствием одно другому. При этом удалялся пациенту ранее желчный пузырь или нет — значения не имеет.
Если клиническую картину дополняет острое гнойное воспаление протоков (холангит), врач назначает срочное проведение операции. В случае нетяжелой формы холангита сначала назначается курс антибиотиков, и уже затем проводится плановая ЭПСТ.
Также данный метод часто рекомендуют для больных старшего возраста при отсутствии воспаления. В зависимости от результатов обследования при нормальном состоянии здоровья более молодым, пациенту чаще всего проводят хирургическую ревизию желчных путей вместо папиллосфинктеротомии.
Применяют ретроградную холангиопанкреатографию вместе с ЭПСТ и при остром и хроническом панкреатите, заболеваниях печеночных и панкреатических протоков, которые требуют биопсии. Еще не так давно врачи считали острый панкреатит противопоказанием к применению операции, поскольку среди всех возможных осложнений после эндоскопической папиллосфинктеротомии именно воспаление поджелудочной железы случалось наиболее часто. Однако последние исследования при фибродуоденоскопии показали положительные изменения после операции. Основываясь на исследовательских выводах, врачи признали ЭПСТ одним из главных методов при панкреатите желчнокаменного происхождения. Показаниями служат также рубцовый и опухолевой стеноз большого сосочка двенадцатиперстной кишки.
Специалисты отмечают, что после эндоскопической папиллосфинктеротомии зачастую не требуется удаление желчного пузыря, такая необходимость после прочищения протока в дальнейшем наблюдается лишь у каждого пятого пациента. К тому же, если по какой-то причине удаление камней во время процедуры невозможно, она помогает устранить гипертензию и холангит, а дальнейшее лечение проходит при более благоприятной клинической обстановке.
Проведение ЭПСТ противопоказано людям, у которых:
- геморрагический диатез, когда организм склонен к кровоизлияниям и кровотокам;
- непереносимость йодистых препаратов;
- длительный стеноз дистального отдела.
Осложнения после врачебного вмешательства
При вмешательстве в наш организм всегда существует риск осложнений. Так, при эндоскопической папиллосфинктеротомии у каждого десятого больного случается кровотечение, перфорация двенадцатиперстной кишки, развивается панкреатит, возможен септический шок. Однако только 2-3% считаются опасными для жизни. Статистика летального исхода еще более утешительна – меньше 1%. После операции больному требуется наблюдение врача и профилактическое лечение.
Минимизировать риск осложнений может высококвалифицированный специалист, который владеет не только данным методом, но и другими видами эндоскопических операций на желудочно-кишечном тракте.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Источник
Проблема целесообразности применения ретроградной холангиопанкреатографии (РХПГ) и эндоскопической папиллосфинктеротомии (ЭПСТ) при панкреатите, в частности остром, не решена во всем мире. Об ЭПСТ при билиарном панкреатите впервые было сообщено Classen и соавт. в 1978 г., ЭПСТ была произведена 17 пациентам и во всех случаях привела к полному выздоровлению. Однако во многих руководствах по хирургии и эндоскопии острый панкреатит считается противопоказанием к ЭПСТ, но при этом зачастую не учитывается его этиология.
У больных острым билиарным панкреатитом (ОБП) путем эндоскопического вмешательства причина обструкции, в частности камни протока, может быть устранена с меньшим риском, чем при хирургической операции. Однако РХПГ и ЭПСТ сами по себе вызывают панкреатит более чем у 3-5% пациентов, возможны и другие осложнения – кровотечение, перфорация.
Цель представленного далее исследования заключалась в оценке целесообразности проведения ЭПСТ в комплексе лечебных мероприятий у больных с ОБП и эффективности этого комплексного лечения в сравнении с традиционной консервативной терапией.
Материал и методы
В исследовании участвовали 107 больных, лечившихся в Воронежской областной клинической больнице по поводу ОБП. Пациенты с механической желтухой не были исключены из исследования.
Всех больных разделили на две группы:
1-ю группу составили 60 человек, в комплекс лечения ОБП которых, помимо традиционной терапии, была включена ЭПСТ;
во 2-ю вошли 47 человек, которым проводилась только консервативная терапия.
Средний возраст больных 1-й группы составил 52,25 года (от 17 до 80 лет), 2-й – 47,8 года (от 21 года до 75 лет). Мужчин в 1-й группе было 10 (16,7%), женщин – 50 (83,3%), во 2-й – соответственно 17 (36,2%) и 30 (63,8%).
Обследование больных включало оценку тяжести ОБП по системе APACHE II, определение в крови уровня аспартатаминотрансферазы (АсАТ), аланинаминотрансферазы (АлАТ), амилазы, общего, свободного и связанного билирубина, учитывалась также выраженность болевого синдрома. Все эти показатели оценивались в следующие сроки:
I этап – при поступлении в стационар;
II этап – в 1-е сутки после ЭПСТ или начала консервативной терапии;
III этап – между 4-ми и 8-ми сутками, т.е. перед оперативным вмешательством по поводу желчнокаменной болезни (холецистэктомия и/или наложение билиодигестивного анастомоза) либо перед выпиской из стационара.
Всем пациентам при поступлении в стационар проводилось УЗИ органов брюшной полости, и практически у всех были обнаружены признаки панкреатита (повышение эхоплотности, неоднородность эхоструктуры поджелудочной железы, а в некоторых случаях и увеличение ее размеров).
Во время проведения РХПГ использовались эндоскопы модели /7-720, /7-730 и /710, применялись водорастворимые рентгеноконтрастные препараты. Для ЭПСТ использовался папиллотом КБ-22, в редких случаях – игольчатый нож. При наличии эндоскопических признаков панкреатита проводилась селективная ретроградная холангиография (без контрастирования вирсунгова протока). Но у некоторых пациентов 1-й группы контрастное вещество попадало в главный панкреатический проток либо путем рефлюкса, либо при целенаправленном его контрастировании, если эндоскопических признаков панкреатита не наблюдалось. В общей сложности таких больных было 17 (28,3%). У всех этих пациентов контрастное вещество из вирсунгова протока по окончании исследования удалялось.
Результаты и обсуждение
Почти у всех больных при РХПГ были обнаружены признаки нарушения желчеоттока, что и дало основание для отнесения панкреатита к билиарному.
При анализе результатов выявлено, что число случаев, когда причину нарушения желчеоттока не удалось установить, во 2-й группе было достаточно велико. Это связано с большими сложностями диагностики у этих больных, поскольку им по сравнению с больными 1-й группы гораздо реже проводилась РХПГ, которая наиболее информативна в данной ситуации. Пациентам, которым РХПГ не проводилась, билиарная природа нарушения желчеоттока устанавливалась на основании данных анамнеза, осмотра, УЗИ и лабораторных показателей. Эхопризнаки билиарной гипертензии (расширение общего желчного протока) в 1-й группе были обнаружены у 16 (26,6%) больных, во 2-й – у 11 (23,4%).
При оценке тяжести ОБП по системе APACHE II на этапах исследования было выявлено, что при поступлении в 1-й группе тяжелое течение заболевания (8 баллов и более) наблюдалось у 7 (11,6%) пациентов, средней тяжести (4-7 баллов) – у 30 (50%), легкое (менее 4 баллов) – у 23 (38,3%). Во 2-й группе с тяжелым панкреатитом было 6 (12,7%) пациентов, со среднетяжелым – 23 (49%), с легким – 18 (38,3%).
Динамика ОБП в 1-й группе на II этапе (1-е сутки после ЭПСТ) была следующей:
у 5 пациентов тяжелый панкреатит перешел в среднетяжелый и легкий;
у 2 его течение не изменилось;
у 11 претерпело отрицательную динамику – из среднетяжелого перешел в тяжелую форму, но это явление было кратковременным – от нескольких часов до 2 сут.
Утяжеление панкреатита произошло у части больных, которым по вышеназванным причинам контрастный препарат во время РХПГ попадал в вирсунгов проток. В общей сложности число пациентов с тяжелым панкреатитом в 1-е сутки после ЭПСТ составило 13 (21,7%), с ОБП средней тяжести – 20 (33,3%), с легким – 15 (25%), а у 12 (20%) больных к этому сроку симптомы острого панкреатита уже были купированы.
У пациентов 2-й группы существенной динамики в течении заболевания через 1 сутки от начала консервативной терапии не отмечалось, и их распределение соответственно тяжести ОБП было следующим:
тяжелая форма – 6, или 12,7% (у одного больного панкреатит из тяжелого перешел в среднетяжелый, а у одного была обратная динамика);
среднетяжелая – 19 (40%);
легкая – 17 (36,2%);
купирование симптомов в этой группе имело место у 5 (10,6%) человек.
На III этапе исследования в 1-й группе лишь у 1 (1,7%) пациента сохранялся ОБП тяжелой формы, средняя степень тяжести наблюдалась у 6 (10%), легкая – у 10 (16,7%), а у 43 (71,7%) явления ОБП были полностью купированы. Во 2-й группе количество пациентов с тяжелой формой заболевания увеличилось до 9 (19,1%), средняя степень тяжести сохранялась у 16 (34%), легкая – у 11 (23,4%) и явления панкреатита были купированы у 11 (23,4%). Из последних данных видно, что тяжелая форма ОБП особенно плохо поддается традиционной консервативной терапии при сравнении с лечением, в комплекс которого включена ЭПСТ.
Динамика болевого синдрома коррелировала с тяжестью ОБП на всех этапах исследования в обеих группах. При поступлении в стационар все больные предъявляли жалобы на боли, характерные для панкреатита. Уже на II этапе 6 (10%) пациентов 1-й группы и 2 (4,2%) из 2-й отмечали значительное уменьшение интенсивности болей, а соответственно 12 (20%) и 5 (10,6%) – их полное прекращение (считалось, что у больного нет болей в 1-е сутки после ЭПСТ, если их удавалось купировать доступными способами в течение этих же суток). Еще у 10 (16,6%) человек в 1-й группе и 11 (23,4%) во 2-й боли уменьшились к III этапу исследования, а соответственно у 31 (51,6%) и 6 (12,8%) они к этому времени полностью исчезли. При этом у 7 (11,7%) пациентов 1-й и 1 (2,1%) 2-й группы отмечено усиление болей на II этапе исследования. В 1-й группе эти больные были из числа тех, кому проводилось контрастирование вирсунгова протока во время РХПЕ. К III этапу исследования у этих пациентов боль уменьшилась или полностью исчезла. Лишь у 3 (5%) больных 1-й и 4 (8,5%) 2-й группы на III этапе боль усилилась по сравнению с той, которую они отмечали при поступлении.
В общей сложности к III этапу исследования боль полностью купировалась у 43 (71,7%) пациентов 1-й группы и 11 (23,4%) 2-й. При этом половине (8) больным 2-й группы из тех, у кого боль исчезла или значительно уменьшилась к 4-8-м суткам от начала терапии (всего таких больных было 17), в течение этого времени была выполнена операция с целью устранения нарушений желчеоттока (холедохолитотомия и дренирование общего желчного протока, наложение билиодигестивного анастомоза, трансдуоденальная папиллосфинктеропластика).
Без существенной динамики на всех этапах исследования болевой синдром сохранялся у 4 (6,6%) пациентов 1-й и 18 (38,3%) 2-й группы.
Наиболее ярко воздействие ЭПСТ на поджелудочную железу отражает содержание в крови амилазы: ее уровень достоверно возрастал на II этапе по сравнению с исходными данными (р=0,004). При подробном изучении результатов видно, что амилаземия после ЭПСТ носит транзиторный характер – она продолжалась от 1 до 3 суток, наиболее существенное повышение уровня этого фермента в крови наблюдалось в первые 30-120 мин после ЭПСТ, но в некоторых случаях более выраженный его подъем отмечался на 2-е сутки после эндоскопического вмешательства. Затем содержание амилазы, как правило, снижалось (на III этапе оно было достоверно ниже, чем на II: ^=0,004).
Существенные и статистически значимые изменения претерпела АлАТ: ее концентрация в крови на III этапе была достоверно ниже (^=0,026), чем на I этапе, у пациентов 1-й группы, кроме того, она была значительно и достоверно (^=0,019) ниже, чем на III этапе у пациентов 2-й группы, у которых содержание этого фермента нарастало по сравнению с I этапом. Это свидетельствует о более благоприятном влиянии комплексного лечения с включением ЭПСТ на гепатоциты по сравнению с традиционной консервативной терапией в условиях нарушения желчеоттока.
Таким образом, при поступлении в стационар группы пациентов были однородными как по критериям APACHE II, так и по основным лабораторным и клиническим показателям. На II этапе у небольшого числа пациентов 1-й группы происходило утяжеление ОБП, усиление болей и ухудшение лабораторных данных, но все эти изменения были кратковременными, и уже к III этапу исследования состояние здоровья в отношении ОБП у подавляющего большинства пациентов 1-й группы по всем оцениваемым параметрам было значительно лучше, чем у пациентов 2-й группы.
Источник
В настоящее время тактика лечения острого некротического панкреатита до конца не определена [4, 5, 7]. В частности, остается нерешенным вопрос о выборе метода декомпрессии желчевыводящей системы, хотя билиарная гипертензия при панкреонекрозе развивается довольно часто [1, 3]. Причиной может являться сдавление желчных протоков извне при развитии воспалительных инфильтратов. В других наблюдениях первичными оказываются патологические изменения билиарной системы, и развитие острого панкреатита происходит вследствие нахождения в ампуле большого сосочка двенадцатиперстной кишки (БСДК) конкремента, который перекрывает устье главного панкреатического протока (ГПП), создавая панкреатическую гипертензию. Со временем может произойти самостоятельное отхождение конкремента в двенадцатиперстную кишку с восстановлением свободного оттока желчи, однако воспалительные изменения в области устья ГПП поддерживают прогрессирование запущенных ранее механизмов повреждения поджелудочной железы. Иногда ущемленный конкремент может сместиться из ампулы сосочка назад и флотировать в просвете общего желчного протока.
Необходимость декомпрессии желчных путей является показанием к устранению препятствия оттоку желчи эндоскопическими методами либо к наложению холецистостомы. Однако рекомендации выполнения эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) при остром некротическом панкреатите довольно осторожны в связи с возможным в результате повышения давления в панкреатических протоках отрицательным влиянием на поджелудочную железу [2, 8, 10]. В настоящем исследовании была поставлена задача оценить эффективность и возможные отрицательные последствия ЭРХПГ при остром некротическом панкреатите и билиарной гипертензии. Для этого были проанализированы осложнения ЭРХПГ и проведена сравнительная оценка эффективности ЭРХПГ и холецистостомии у данной категории больных.
В исследование были включены 40 больных острым некротическим панкреатитом и признаками билиарной гипертензии. Критерием исключения из исследования являлась алкогольная или посттравматическая этиология заболевания. Во всех наблюдениях наличие билиарной гипертензии было достоверно подтверждено после применения методов декомпрессии. Анализировали клинические результаты лечения, данные ультразвуковых исследований, компьютерной томографии, ЭРХПГ, фистулографии (при дренировании желчного пузыря) и лабораторные данные. Тяжесть состояния больных оценивали при поступлении в стационар по шкале тяжести физиологического состояния (ТФС), масштабы поражения брюшной полости — по индексу поражения брюшной полости (ИПБП) [6], выраженность синдрома системной вопалительной реакции (ССВР) — по критериям согласительной конференции 1991 г. [9] и тяжесть полиорганной недостаточности (ПОН) — по шкале Sepsis-related organ failure assessment (SOFA). Все пациенты получали комплексную консервативную терапию согласно принятым стандартам лечения. Основная и контрольная группы различались применением методов разрешения билиарной гипертензии. Пол, возраст и тяжесть состояния больных в группах были сопоставимы.
Основная группа состояла из 22 пациентов с острым некротическим панкреатитом, развившемся на фоне желчнокаменной болезни; в целях купирования желчной гипертензии им была выполнена ЭРХПГ с эндоскопической папиллосфинктеротомией (ЭПСТ) и ревизией желчных протоков, в 19 наблюдениях дополненная литоэкстракцией. В группе было 27% мужчин и 73% женщин в возрасте от 18 до 87 лет. Средний возраст составил 54,1±3,7 года. Тяжесть состояния у всех больных при поступлении в стационар по шкале ТФС не превышала 11 баллов, т.е. не было пациентов в крайне тяжелом состоянии.
Выполняя ЭРХПГ на фоне развившегося некротического панкреатита, придерживались нескольких правил. Срочность манипуляции определяли на основании наличия признаков острой окклюзии ампулы БСДК с учетом клинико-лабораторных и ультразвуковых данных, а также результатов эндоскопического осмотра БСДК. При наличии признаков острой окклюзии ЭРХПГ производили экстренно в ближайшие часы. В случае подозрения на холедохолитиаз без острой окклюзии ЭРХПГ выполняли после улучшения состояния пациента. На диагностическом этапе ЭРХПГ стремились к селективной канюляции устья общего желчного протока, избегая контрастирования ГПП, чтобы не вызвать дополнительного повреждения и инфицирования поджелудочной железы.
Для этих целей применяли нитиноловые струны-проводники, что позволяло облегчить не только селективную канюляцию, но и выполнение ЭПСТ с литоэкстракцией, значительно уменьшить травматизацию сосочка и тем самым снизить риск прогрессирования панкреонекроза. При выявлении ущемленного конкремента в ампуле не использовали канюляционный способ ЭПСТ, так как при этом можно травмировать слизистую в области устья ГПП. Производили рассечение «крыши» ампулы сосочка атипично с помощью игольчатого электрода в области наибольшего выбухания продольной складки. При необходимости такой разрез продлевали обычным способом. После удаления ущемленного конкремента выполняли контрастирование желчных протоков и при выявлении конкрементов — литоэкстракцию с помощью корзинки Дормиа.
В основной группе в 41% наблюдений ЭРХПГ была выполнена в 1-2-е сутки после госпитализации, в остальных наблюдениях — в более поздние сроки. Исходно при определении показаний к манипуляции конкременты общего желчного протока были четко выявлены только в 23% наблюдений. Еще у 63% больных была обнаружена дилатация желчных протоков без визуализации конкрементов, но в 14% наблюдений расширение протоков отсутствовало, и наличие препятствия в протоках заподозрено в связи с существенным повышением уровня билирубина крови за счет прямой фракции на фоне желчнокаменной болезни. После уточнения диагноза в ходе проведения ЭРХПГ выяснилось, что причиной развития билиарной гипертензии у 14% пациентов основной группы явились деформация и стеноз БСДК и у 86% — холедохолитиаз, причем синдром острой окклюзии терминального отдела общего желчного протока имел место только у 23% больных, а у 63% больных отмечались флотирующие конкременты общего желчного протока.
Контрольная группа состояла из 18 пациентов, которым в целях купирования билиарной гипертензии исходно было выполнено дренирование желчного пузыря. В группе было 39% мужчин и 61% женщин в возрасте от 24 до 79 лет. Средний возраст составил 52,8±3,6 года. Желчнокаменная болезнь имелась у 66% пациентов. Тяжесть состояния у всех больных при поступлении в стационар не превышала 11 баллов. При определении показаний к холецистостомии дилатация желчных протоков была выявлена в 80% наблюдений, причем конкременты общего желчного протока исходно не были выявлены ни в одном наблюдении, хотя при последующей фистулографии они диагностированы у 13% больных.
В 20% наблюдений ультразвуковые признаки расширения протоков отсутствовали, показанием к холецистостомии явилось повышение уровня билирубина крови за счет прямой фракции и значительное увеличение желчного пузыря. В последующем 2 больным в связи с получением при фистулографии данных о холедохолитиазе была выполнена ЭРХПГ с литоэкстракцией. У 10 пациентов, имевших конкременты желчного пузыря, холедохолитиаз при фистулографии выявлен не был. Возможно, имело место самостоятельное отхождение конкремента либо причиной билиарной гипертензии являлось сдавление общего желчного протока воспалительным инфильтратом. У пациентов, у которых исходно отсутствовало расширение желчных протоков и в последующем при фистулографии не было обнаружено внутрипротоковых изменений, наличие билиарной гипертензии подтверждалось большим количеством желчи, оттекающей по холецистостоме (600-900 мл в сутки).
Проанализированы наблюдения неблагоприятного течения заболевания после выполнения ЭРХПГ. Серьезного ухудшения состояния с необходимостью перевода на ИВЛ и вазопрессоры непосредственно после вмешательства у 22 пациентов основной группы и у 2 пациентов контрольной группы, которым ЭРХПГ была выполнена на втором этапе лечения, не зарегистрировано. У 2 больных в течение суток после выполнения ЭРХПГ отмечалось умеренное снижение артериального давления, не потребовавшее медикаментозной поддержки гемодинамики, у 1 пациентки старческого возраста в течение нескольких суток наблюдались нарушения психического статуса с дезориентацией. Все 3 (13%) наблюдения были расценены как осложнения наркоза и не имели серьезных последствий. Кровотечений из зоны ЭПСТ также не было.
В 3 (13%) наблюдениях в период после выполнения эндобилиарного вмешательства имела место некоторая отрицательная динамика ультразвуковой картины, однако только в одном из них она сопровождалась клиническими и лабораторными признаками прогрессирования панкреонекроза. В 2 других наблюдениях уровень амилазы крови после выполнения ЭРХПГ, напротив, снизился, а лейкоцитоза, других признаков ССВР и отрицательной клинической динамики не было. Однозначно расценить такую динамику как отрицательные последствия ЭРХПГ возможно только в первом из описанных наблюдений.
Еще в 6 (25%) наблюдениях после выполнения ЭРХПГ имело место кратковременное повышение уровня амилазы, не сопровождавшееся прогрессированием острого некротического панкреатита. В 5 из этих 6 наблюдений повышение уровня амилазы было совсем небольшим — не более чем на 100 ед., в 1 произошло значительное повышение уровня амилазы — до 1779 ед. и содержания лейкоцитов крови до 13,5·109/л, однако уже через 2 сут эти показатели нормализовались, а при контрольном УЗИ отмечалась положительная динамика течения заболевания. У 71±9% больных после выполнения ЭРХПГ с ЭПСТ уровень амилазы крови достоверно снижался. Уровень амилазы мочи после выполнения ЭРХПГ, как правило, слегка повышался и составлял в среднем 750±170 ед., при том что в момент поступления этих больных в стационар он был в 13 раз выше и составлял 10 083±384 ед.
Таким образом, выполнение эндобилиарных ретроградных вмешательств больным острым некротическим панкреатитом действительно сопровождается риском дополнительного повреждения поджелудочной железы. Однако в большинстве наблюдений последствия ограничивались развитием транзиторной амилаземии, в то время как прогрессирование панкреонекроза, подтвержденное клиническими, лабораторными и инструментальными данными, отмечалось всего у 4±4% больных. При этом тяжелого течения острого некротического панкреатита с развитием ПОН после выполнения ЭРХПГ не наблюдалось.
В табл. 1 и 2
 и на рис. 1-4
и на рис. 1-4 Рисунок 1. Динамика средних значений общего и прямого билирубина крови.
Рисунок 1. Динамика средних значений общего и прямого билирубина крови. Рисунок 2. Динамика средних значений амилазы крови и АСТ.
Рисунок 2. Динамика средних значений амилазы крови и АСТ. Рисунок 3. Динамика средних значений лейкоцитов крови.
Рисунок 3. Динамика средних значений лейкоцитов крови. Рисунок 4. Динамика средних значений гемоглобина и общего белка крови. представлена динамика средних значений различных показателей у больных. Общий билирубин крови, исходный уровень которого был значительно повышен, достоверно снизился на 18,9±6,2 мкмоль/л уже в 1-е сутки после ЭРХПГ и полностью нормализовался в течение 3-5 сут. Прямой билирубин в 1-е сутки достоверно снизился на 20,3±6,6 мкмоль/л и в течение 3-5 сут достиг уровня 6,6 мкмоль/л. Диаметр общего желчного протока, по данным УЗИ, через сутки после ЭРХПГ уменьшился на 3,2±0,5 мм, вернувшись к норме, длина желчного пузыря — на 21,3±4,1 мм. Имело место также быстрое и достоверное снижение уровня аминотрансфераз.
Рисунок 4. Динамика средних значений гемоглобина и общего белка крови. представлена динамика средних значений различных показателей у больных. Общий билирубин крови, исходный уровень которого был значительно повышен, достоверно снизился на 18,9±6,2 мкмоль/л уже в 1-е сутки после ЭРХПГ и полностью нормализовался в течение 3-5 сут. Прямой билирубин в 1-е сутки достоверно снизился на 20,3±6,6 мкмоль/л и в течение 3-5 сут достиг уровня 6,6 мкмоль/л. Диаметр общего желчного протока, по данным УЗИ, через сутки после ЭРХПГ уменьшился на 3,2±0,5 мм, вернувшись к норме, длина желчного пузыря — на 21,3±4,1 мм. Имело место также быстрое и достоверное снижение уровня аминотрансфераз.
В среднем у больных произошли значительное снижение уровня амилазы крови в 1-е сутки после выполнения ЭРХПГ и полная нормализация этого показателя в течение 3-5 сут. Размеры головки поджелудочной железы достоверно уменьшились также уже в 1-е сутки. Сразу несколько снизились количество признаков ССВР и балльная оценка органных нарушений у больных. Достоверное снижение содержания лейкоцитов произошло не сразу, но к 3-5-м суткам их уровень практически нормализовался. Следует также отметить, что после выполнения ЭРХПГ отсутствовало значимое снижение уровней гемоглобина и общего белка крови. Все это свидетельствует о положительной динамике течения острого деструктивного панкреатита после устранения внутрипротоковых изменений, которые являлись и причиной нарушения оттока желчи, и причиной развития панкреонекроза.
После выполнения ЭРХПГ произошло полное купирование признаков билиарной гипертензии и в большинстве наблюдений отмечены достоверная положительная динамика течения острого некротического панкреатита, а также уменьшение поражения печени. Окончательно клинические результаты лечения были оценены при сравнении основной и контрольной групп. Результаты сравнения приведены в табл. 3 и на рис. 1-4. Исходно группы были сопоставимы по показателям, которые могут влиять на течение заболевания. При этом сравнительная оценка показала, что в основной группе были достоверно меньше масштабы поражения, летальность, частота гнойных осложнений и сроки госпитализации больных.
и на рис. 1-4. Исходно группы были сопоставимы по показателям, которые могут влиять на течение заболевания. При этом сравнительная оценка показала, что в основной группе были достоверно меньше масштабы поражения, летальность, частота гнойных осложнений и сроки госпитализации больных.
Разница в летальности составила 22±9%, частоте гнойных осложнений — 28±11%, сроках пребывания выздоровевших больных в стационаре — 22±6,4 сут. Масштабы поражения при дренировании желчного пузыря были выше на 4,4±0,9 балла. Динамика лабораторных показателей также свидетельствует о более высокой эффективности ЭРХПГ как в купировании желчной гипертензии, так и в непосредственном лечении панкреонекроза. После холецистостомии наблюдались более медленные темпы купирования желтухи, снижения уровня аминотрансфераз и амилазы крови. Кроме того, отсутствовала нормализация содержания лейкоцитов крови и наблюдалось снижение уровня гемоглобина (к 3-5-м суткам почти на 30 г/л по сравнению со значением до холецистостомии; p<0,002) и общего белка крови (к 3-5-м суткам почти на 9 г/л по сравнению со значением до холецистостомии; p<0,05). Следовательно, прогрессирование панкреонекроза при дренировании желчного пузыря обычно удавалось прервать в более поздние сроки, чем при выполнении ЭРХПГ с ЭПСТ и литоэкстракцией.
Полученные данные позволяют утверждать, что при остром некротическом панкреатите с билиарной гипертензией в целях ее устранения эффективно первичное выполнение ЭРХПГ с эндобилиарным вмешательством. Перенесение его на второй этап лечения — после купирования желтухи с помощью дренирования желчного пузыря — не приводит к улучшению результатов лечения. В то время как при первичном выполнении ЭРХПГ гнойных осложнений не было вовсе, а сроки госпитализации больных не превышали 30 сут, из двух наблюдений, в которых ЭРХПГ выполняли после наложения холецистостомы, в одном развился абсцесс сальниковой сумки, потребовавший повторных открытых операций, ИПБП составил 15 баллов, срок госпитализации — 50 сут.
Таким образом, проведенный анализ свидетельствует о высокой эффективности и низком риске развития тяжелых осложнений ЭРХПГ с ЭПСТ и литоэкстракцией при лечении больных острым некротическим панкреатитом с патологическими изменениями билиарной системы при соблюдении определенных мер предосторожности. Необходимо избегать контрастирования главного панкреатического протока, а при ущемлении конкремента в ампуле не использовать канюляционный способ ЭПСТ. Патологические изменения желчных протоков являются у этих пациентов причиной как билиарной гипертензии, так и острого панкреатита. В связи с этим ЭРХПГ не только эффективно устраняет желчную гипертензию, но и в большинстве наблюдений обеспечивает положительную динамику течения острого некротического панкреатита. В то же время дренирование желчного пузыря купирует механическую желтуху, но не устраняет имеющиеся у таких пациентов изменения желчных протоков. Вопрос об их устранении переносится на более поздние сроки, при этом в ряде наблюдений сохраняются причины прогрессирования панкреонекроза.
Мы считаем, что в тех ситуациях, в которых имеются данные о патологических изменениях желчных протоков как причине билиарной гипертензии у больного острым некротическим панкреатитом, предпочтительно выполнение не холецистостомии, а ЭРХПГ с ЭПСТ и (при необходимости) с литоэкстракцией. Вопрос о возможности выполнения ЭРХПГ пациентам с панкреонекрозом, поступающим в крайне тяжелом состоянии, с выраженными гемодинамическими и дыхательными нарушениями, в настоящем исследовании не рассматривался.
Источник


