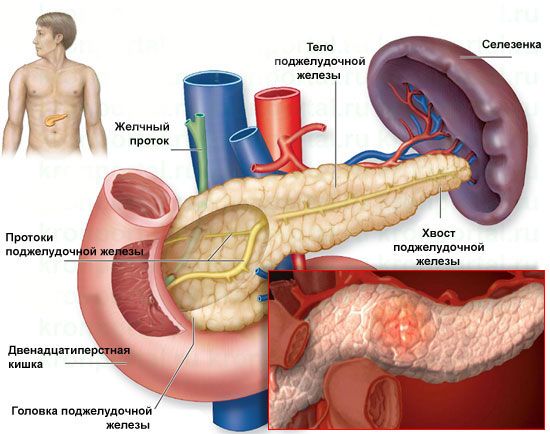
Хирургического лечения острого деструктивного панкреатита
8.1. Исторические сведения
С
момента возникновения учения об остром
панкреатите можно проследить несколько
этапов формирования воззрения на его
хирургическое лечение. Оно менялось в
зависимости от представлений о патогенезе
заболевания, диагностических и
лечебных возможностей. Еще в 1894 г. Korte
предложил лечить панкреатит оперативным
путем. В 1925 г. И.Г. Русланов говорил о
приоритете хирургического лечения
острого панкреатита. По мере накопления
опыта появилось другое мнение. Так,
Walsel,
et
al.
(1927) показали, что хирургическое лечение
дает очень высокую летальность и
высказались за консервативное ведение
больных панкреатитом. С 1960 г., в связи
с улучшением методов диагностики и
появлением новых лекарственных
препаратов, возобладала точка зрения
на преимущество консервативной терапии.
Во многом выбор метода лечения зависит
от фазы заболевания, распространенности
процесса, эффективности терапии и
сроков начала лечения (Савельев B.C.,
1978; Маят B.C.
и соавт., 1980 и др.).
R.
Lombard-Platet et al. (1983)
считают необходимым свести к минимуму
показания к экстренным операциям при
остром панкреатите.
Основные
методы операций, проводимых в фазе
токсемии, можно разделить на две группы:
органосохраняющие (открытые и закрытые)
и резекционные. К открытым органосохраняющим
относятся тампонада сальниковой сумки
в сочетании с рассечением брюшины над
поджелудочной железой, марсупиализация.
Вместо тампонов могут быть использованы
резиновые и силиконовые дренажи (Постолов
М.П., 1974; Иванов В. А. и Молоденков М.И.,
1960; и др.). По мнению хирургов, до настоящего
времени от выбора оптимального способа
дренирования во многом зависит течение
послеоперационного периода (Короткий
В.Н. и соавт., 1988.; Хнох Л. и соавт., 1988.).
Очень важным, постоянно обсуждающимся
к литературе вопросом является проблема
выбора дренажа после хирургического
вмешательства (одно-, двух-, трехпросветные,
трубчато-резиновые, ТММК, дренаж Waterman,
сигарный Penrose,
дренажи Chaff
it,
Saratoda
и др.). Сборные статистические данные
середины двадцатого столетия на большом
клиническом материале показали, что
подобные oneрации
закончились летальными исходами в 63,6%
случаев у отечественных и в 62,7% — у
зарубежных хирургов (Серга В.И., 1963).
В
1954 г. А.А. Михальянц, К.Д. Тоскин и соавт.
(1966) предложили операцию
оментопанкреатопексии, при которой
большой сальник проводится через
отверстие в желудочно-ободочной связке
и подшивается к передней поверхности
поджелудочной железы. Различные
модификации данного метода предложены
Л.В. Авдей и соавт. (1974), И.П. Томашук
(1982). Мнения о результатах данного
вмешательства противоречивы (ШаакТ.В.,
1974; Маят B.C.
и соавт., 1982). В.А. Козловым(1977) разработана
и применена в клинике операция
«абдоминизации поджелудочной железы».
Идея
радикального хирургического лечения
при остром панкреатите возникла давно.
Korte
(1895), Hoffman
(1927), С.Г. Рукосуев (1949) произвели
резекцию поджелудочной железы при
панкреонекрозе. В 1963 г. Watts
осуществил первую успешную панкреатэктомию
при панкреонекрозе. В дальнейшем об
успешных операциях на поджелудочной
железе сообщали Б.А. Королев и соавт.
(1972),
В.И.
Филин
(1979), А.А.
Шалимов
(1981), Alehander et al. (1977), Roy et al. (1977).
Nollander
et
al.
(1977) произвели радикальные вмешательства
у 35 больных; летальность составила 34%.
Ranson
(1980) на основании сборной статистики
приводит следующие цифры летальности:
тотальная панкреатэктомия — 67%,
панкреатодуоденэктомия — 43%, дистальная
субтотальная резекция — 41%.
Е.
Kivilaakso
et
al.
(1983) у 17 больных произвели резекцию
поджелудочной железы, а вторую группу
(17 больных) лечили при помощи перитонеального
лаважа. Летальность оказалась почти в
два раза ниже в первой группе (22%) по
сравнению со второй — 47%. J.H.
Alexandre
et
al.
(1985) произвели по поводу панкреонекроза
гастродуоденопанкреатэкто-мию 13 больным,
из них умерло 8 (61%). Наибольшую опасность
в послеоперационном периоде у этих
больных представляет инфекция, дыхательная
и почечная недостаточность. Учитывая
очень высокий риск подобных вмешательств,
авторы рекомендуют их только при некрозе
75-100% ткани железы. Uan
Kemmel
(1976), В.М. Лащевкер (1978) справедливо
указывают, что визуально невозможно
определить распростра* нение некроза
в глубину и по периферии, то есть
установить границы резекции в пределах
здоровых тканей. Сдерживает широкое
применение данных вмешательств их
сложность, особенно в условиях экстренных
операций.
L.N.
Nordback et al. (1985),
изучая отдаленные результаты после
резекции поджелудочной железы,
обнаружили диспепсию в 46% случаев} у 92%
оперированных развился сахарный диабет,
у 42% — возникла полиневропатия. Плохие
отдаленные результаты заставляют
ставить по казания к резекции железы
осторожно. Создается впечатление, что
рекомендации к ранним операциям в стадии
токсемии, когда показанием к вмешательству
является прогрессирующая токсемия,
даются в тех лечебных учреждениях,
где консервативная терапия отработана
недостаточно и применяется не в
полном объеме.
В
фазе гнойных осложнений предложены
различные по объему вмешательства.
Е.
VanVyve
et
al.
(1988) разделяют операции, выполняемые
при наличии стерильных и инфицированных
некротических массах. В первой группе
в основном удалось выполнить внутренние
дренирующие вмешательства; во второй
— наружное дренирование. Авторы
подчеркивают иажное значение
предварительного чрескожного дренирования,
которое удалось провести у 50% больных,
что позволило улучшить состояние (юльных
и выполнить операции с большим эффектом.
В.И.
Филин (1981), Г.П. Гидирим (1983), А.В. Пугаев
(2000) в фазе гнойных осложнений отдают
предпочтение щадящим операциям: I
иекрэктомии и секвестрэктомии, летальность
при которых составила 1,8-27,4%.
Sh.
Gebhardt,
W.
Link
(1982) отметили при дренировании сальниковой
с умки летальность 69%; при комбинации
некрэктомии с промыванием орюшной
полости — 35%. Минимальная летальность
наблюдалась при хирургических
вмешательствах, произведенных на
второй неделе от начала заболевания.
liusheler
E.
et
al.
(1982) отметили, что широкое применение
перитонеаль-ного диализа, некрэктомия
или резекция левых отделов железы
позволи-ii.i
при ранних хирургических вмешательствах
снизить летальность с НО до 27%. S.
Wilson
et
al.
(1988) при некрэктомии и резекции железы
пюбщают о летальности 38%. Авторы отметили
тяжелое течение послеоперационного
периода. Время пребывания в стационаре
составило от 2 до 9 месяцев у больных с
некрэктомией и до 16 месяцев после
резекции. 11осле операций наблюдались
тяжелые осложнения: абсцесс, свищи,
кро-иотечения, а также дыхательная и
почечная недостаточность, диабет. II.G.
Beger
a
M.
Wuchler
(1986) рекомендуют некрэктомию сочетать
с дре-Нажом сальниковой сумки и промыванием
ее (до 12 л/сут.) в течение d
12 дней, что позволило снизить летальность
до 10%. При этом адекватное дренирование
гнойно-некротических полостей
обеспечивается остав-!и иием нескольких
дренажных трубок (Батвинков Н.И. и соавт.,
1987.; I
оскин К.Д. и соавт., 1988.; Renson
J.H.С,
1984). Хотя модифицированные дренажи более
надежны и эффективны, при их применении
отмечается снижение санационной функции
за счет закупорки просвета детритом и
секвестрами, которые постоянно
присутствуют в полости. Для увеличения
сроков функционирования трубок были
предложены различные способы ухода за
ними: промывание, аспирация и т.д. (Каншин
Н.Н. 1989.; Хуторянский И.Н. и соавт., 1993).
Однако единого способа для практического
использования не выработано. Многие из
хирургов применяют тампонирование
забрюшинной клетчатки и сальниковой
сумки (Кубышкин В.А. и соавт., 1987,
Скрипниченко Д.Ф. и соавт., 1988) и тоже
отмечают его низкую эффективность,
травматичность, плохую переносимость
больными. Признавая это, рекомендуется
своевременно менять тампоны и искать
более совершенные методы дренирования.
Н.Н.
Stone et al. (1983)
на основании опыта лечения 57 больных
отдают предпочтение при панкреатических
абсцессах субтотальной резекции
поджелудочной железы с открытой
тампонадой раны и ежедневной сменой
тампонов. Zaicwski
et
al.
(1988) предложили метод лечения абсцессов
сальниковой сумки путем «открытого
живота». После лапаротомии нижний
этаж отграничивается путем подшивания
к ране сальника поперечной ободочной
кишки; абсцесс опорожняют и дренируют
несколькими дренажами и тампонами. Рана
не зашивается, первая перевязка
производится через 12 часов. Из 10
человек, леченных данным методом, умерли
3 от сепсиса; кровотечение из ложа
абсцесса отмечено у 3 больных.
Н.
Pahlig
a.
U.
Gobel
(1988) рекомендуют раннее оперативное
вмешательство без зашивания брюшной
полости с последующим ее дренажом до
улучшения общего состояния в течение
нескольких дней. Объем операций
варьировал от перитонеостомии до
секвестрэктомий и субтотальной
резекции железы. N.G.
Loncscu
et
al.
(1988) положительно оценивают лапаростомию
в лечении панкреонекроза. Первичная
лапаростомия произведена у 14,5%,
вторичная — у 17% больных. При традиционных
хирургических вмешательствах летальность
составила 43%, а после лапа-ростомий —
31%. Техника лапаростомий — вскрытие
сальниковой сумки, удаление
некротических масс, подшивание
желудочно-ободочной связки к краям
раны, тампонада и дренирование.
Прудков
М.И. (1998) и Гостищев В.К. (2000) пропагандируют
более широкое практическое использование
оментобурсостомии для желаемой
пролонгированной санации гнойного
очага.
Lawson
et
al.
(1970) предложили для лечения больных с
панкреонекрозом операцию трех «стомий»:
холецистостомию (для декомпрессии
желчных путей), гастростомию (декомпрессия
желудка) и еюностомию дли питания. Эти
вмешательства рекомендуют White,
Heibasb
(1976), Boymoncl
et
al.
(1980). Ряд авторов предложили только
декомпрессивные операции на желчных
путях (Иванова В.М., Шаак Т.В., 1965; Glenn,
Frey,
1964).
T.R.
Kelly
a
D.S.
Wagner
(1988) на основании изучения большого
клинического материала пришли к выводу,
что камни желчного пузыря вызывают
приступы острого панкреатита, но не
влияют на его прогрессирование, которое
обусловлено активизацией пищеварительных
ферментов. Попытка раннего удаления
камней (холецистэктомия) не улучшает
течения панкреатита и сопровождается
высокой летальностью (15-30%), после стихания
приступа острого панкреатита операция
показана и целесообразна. Летальность
при отсроченных операциях составляет
2,4%
Большинство
хирургов к вмешательствам на поджелудочной
железе, особенно в фазе токсемии,
относятся отрицательно (Чаплинский
В.В. и Гнатышак А.И., 1972; Акжигитов Г.Н.,
1974; Glaser,
1975 и др.). Многие хирурги в фазе токсемии
и ремиссии предпочитают консервативное
лече-ни. Наиболее часто применяемые в
этот период дренирующие вмешательства,
тампонады, абдоминизация железы и другие
операции, как правило, лишены
патогенетического характера и не
останавливают процесса в железе, к тому
же дренирующие вмешательства можно
выполнить под контролем ультразвука.
Хирургические радикальные вмешательства
(резекция железы, панкреатэктомия)
оправданы при отсутствии эффекта от
медикаментозной терапии, однако
недоступны практическим хирургам и
приводят к глубокой инвалидизации
выживших больных.
В
фазе гнойных осложнений предпочтение
должно быть отдано хирургическим
методам лечения (традиционным, пункционным
вмешательствам и т.д.).
В
ряде случаев хирургами применяется
пункция и дренирование гнойных
полостей под контролем УЗИ или КТ
(Брискин Б.С. и соавт., 1989, Кузин Н.М. и
соавт., 1996; Насиров Ф.Н. и соавт., 1988;
Нестеренко Ю.А. и соавт., 1995; Нуднов Н.В.
и соавт., 1992; Панцырев Ю.М. и соавт., 1996;.
Balthazar
et
al.,
1990). Для лечения кист S.
Nanckeal.
Pedersen
(1970) применили прицельную чрескожную
пункцию под контролем УЗИ. Успешная
пункция выполнена у 14 больных, из них у
4 повторена до 5 раз. Е. Ekuligowska
a
W.
Olsen
(1985), R.
Frost
et
al.
(1986) использовали для пункции иглу Хиба,
которую проводили через стенку желудка
в полость кисты с оставлением в ней
тонкого дренажа. Крылов П.Л. (1987), Шалимов
А.А. п соавт. (1986) первые в отечественной
литературе сообщили о санации кист при
помощи пункции под контролем УЗИ.
Гальперин Э.И. и соавт. (1989) произвели
под контролем УЗИ чрескожную пункцию
и санацию кист у 12 больных; из них у 8
осуществлено дренирование. Только в
одном случае пункция кисты оказалась
неэффективной.
Григорьев
Н. и соавт. (1990) применили пункцию
панкреатических псевдокист в 76 случаях.
Кисты локализовались в головке — у 24,
в теле — у
37,
в хвосте — у 15 больных. Лечение выполнялось
при помощи одно-или многократной пункции
с аспирацией содержимого под контролем
ультразвука. При диаметре кисты до 5 см
выздоровление наступило и 83%, при диаметре
кисты до 10 см — в 61%, более 10 см — только
в 11% случаев. Постоянное дренирование
кисты было выполнено у 15 больных, из них
у 13 наступило излечение.
Место
пункционных вмешательств в комплексе
лечения больных еще не определено и
требует накопления материала. Высказываются
мнения о возможности использования
пункционной санации как альтернативы
хирургическому лечению (Шкроб О.С. и
соавт., 1998; Лобаков А.И. и со-авт., 1998;
Pickleman
V.
et
al.,
1987), но вместе с тем делаются заключения
о сомнительной эффективности проводимых
мероприятий (Данилов М.В. и соавт., 1996).
Так, например, приводятся данные о
результативности подобной санации
лишь у трети больных с гнойными
осложнениями пан-креонекроза, что
позволяет рассматривать щадящую санацию
лишь как этап лечения. По другим данным,
пункционное дренирование жидкостных
образований на фоне панкреонекроза
помогает избежать хирургического
вмешательства у 32-69% пациентов (Hancke
S.
et
al.,
1976; VanSon-nenberg
E.
et
al.,
1985). Особое внимание при этом уделяется
отбору больных, у которых можно
считать применение пункционной санации
перспективным. Прежде всего, это пациенты
со сформированными достаточно
однородными однокамерными жидкостными
включениями на фоне панкреонекроза
(Rotman
N. et
al.,
1992). Однако немногочисленность
наблюдений не позволяет сегодня говорить
о ценности щадящего лечения при гнойных
осложнениях острого панкреатита для
клинической практики (Гальперин Э.И. и
соавт., 1990; Затевахин И.И. и соавт., 1996).
Сегодня
в литературе широко обсуждаются вопросы
еще одной разновидности щадящей
санации гнойников на фоне панкреонекроза.
При благоприятных анатомических
соотношениях (интимной связи образования
с желудком и двенадцатиперстной кишкой)
используется дренирование жидкостных
образований под гастроскопическим
контролем. У многих хирургов (Ермолов
А.С, 2001; Данилов М.В. и соавт., 2000) вызывает
сомнение возможность излечения обширных
флегмон забрюшинного пространства при
помощи закрытого дренирования.
Таким
образом, из приведенного материала
следует, что стройной системы
хирургических мероприятий, позволяющей
улучшить результаты лечения, нет, и ее
разработка для широкой клинической
практики являет ся реальной необходимостью.
Источник
В настоящее время заболеваемость, инвалидизация и смертность от острого панкреатита и панкреонекроза занимает одно из ведущих мест среди острой хирургической патологии у лиц молодого возраста, преимущественно мужского пола. Одна из характерных черт последнего времени – заболевание отмечается у трудовостребованных лиц, что сопряжено с удовлетворительным материальным положением пациента и, вследствие этого, перееданием, злоупотреблением алкоголем и повышенной массой тела, что в свою очередь является пусковым механизмом заболевания и факторами, усложняющими все виды лечения и отягчающими прогноз заболевания. По литературным данным общая летальность от острого деструктивного панкреатита превышает 30%, а при развитии тяжелых форм осложнений достигает 100%.
По данным департамента здравоохранения Краснодарского края («Основные показатели здоровья и здравоохранения Краснодарского края за 6 месяцев 2005 года») демографическая ситуация в крае, как и в целом по РФ, остается сложной, вследствие нарастающей депопуляции населения. В общей структуре, смертность от болезней пищеварения увеличилась на 10,2 %. Рост общей смертности произошел за счет населения в трудоспособном и старше трудоспособного возрастах. Следует отметить рост смертности от болезней органов пищеварения в Краснодарском крае, превышает показатели по ЮФО в целом. Показатель выхода на инвалидность в крае в 2004 году увеличился в сравнении с 2002-2003 г.г. и составил 84,2 на 10 тыс. населения, превысив российский показатель на 11%. В структуре смертности по краю за 5 месяцев 2004-2005 г.г. от панкреатита умерло 274 пациента.
По данным медицинских учреждений, занимающихся проблемой деструктивного панкреатита, существенного прогресса и улучшения результатов лечения от повсеместного применения общепринятой тактики и методов хирургического лечения не наблюдается.
Считается, что основными элементами комплексного лечения острого панкреатита и панкреонекроза являются: интенсивная терапия и многочисленные открытые хирургические вмешательства на поджелудочной железе, забрюшинном пространстве и брюшной полости, в том числе, направленные на санацию гнойно-некротических очагов. Однако разрозненность в применении различных методик лечения этой крайне сложной хирургической патологии в клиниках края и отсутствие необходимого внимания со стороны руководителей учреждений здравоохранения обуславливают стабильность неутешительных показателей смертности и инвалидизации пациентов данной группы на протяжении последних десятилетий.
Более чем 13-летний опыт работы Российского центра функциональной хирургической гастроэнтерологии (ФГУ «РЦФХГ Росздрава»), на базе которого курировались тяжелейшие пациенты с острым деструктивным панкреатитом, панкреонекрозом, а так же литературные данные, свидетельствуют о необходимости внесения в базовые элементы комплексного лечения существенных дополнений, без которых невозможно преодолеть кризис в проблеме лечения этой патологии.
Наличие собственных научных фундаментальных, экспериментальных, клинических и практических разработок, квалифицированных врачебных кадров, способных выполнять весь спектр современных вмешательств на органах брюшной полости и забрюшинного пространства, проводить анестезиологическое пособие и интенсивную терапию, в сочетании с новейшими техническими достижениями инструментостроения, позволило ученым ФГУ «РЦФХГ Росздрава» сформировать новую функциональную единицу – «Инновационный Центр неотложной панкреатологии».
Центр по лечению неотложных состояний, связанных с патологией поджелудочной железы, является результатом сформировавшихся функциональных взаимодействий между клиническими и научными подразделениями ФГУ «РЦФХГ Росздрава», что обеспечивает постоянное обновление за счет непрерывного внедрения научных разработок и технических усовершенствований. Являясь структурной основой для применения современных медицинских технологий в лечении деструктивного панкреатита, инновационный центр аккумулирует основные инструменты визуализации и интраскопического манипулирования.
В основу панкреатологического центра положена измененная коренным образом идеология лечения деструктивного панкреатита, в основании которой следующие принципы:
Принцип минимальной инвазивности.
Основным хирургическим вмешательством является малоинвазивное (малотравматичное) хирургическое пособие под интраскопическим контролем (ультразвуковым, рентгенологическим, эндоскопическим).
Как известно, лапаротомия (вскрытие брюшной полости) и люмботомия (вскрытие забрюшиного прстранства) требовались для вскрытия гнойных очагов в поджелудочной железе и забрюшинной клетчатке, удаления некротизированных тканей и секвестров. Лапаротомия завершалась, обычно, формированием лапаростомы (швы на рану не накладывались, брюшная полость оставалась открытой), после чего обеспечивался отток воспалительного экссудата и панкреатического секрета, через лапаротомическую рану осуществлялся повторный доступ к железе для последующих секвестрэктомий (удаление некротезированных участков железы) и других санирующих процедур.
В настоящее время все эти задачи, возможно, решить, не прибегая к открытому вмешательству, а лапаротомия, люмботомия и лапаростомия перестают быть основой хирургии острого деструктивного панкреатита. Отказ от выполнения открытых вмешательств на органах брюшной полости и забрюшинного пространства и непосредственно на поджелудочной железе является основным психологическим барьером для всех хирургических учреждений, который потребовалось преодолеть. Именно сама лапаротомия, как тяжелейший травматический фактор на фоне имеющейся катастрофы и полиорганной недостаточности, многочисленные осложнения виде кишечных свищей и кровотечения от прямого открытого вмешательства на измененных тканях и органах, являются одними из основных причин неблагоприятного исхода.
Современный уровень развития медицинской техники (технологический прогресс) позволяет применять исключительно оборудование для закрытых вмешательств на всех органах. Возникающие в процессе малоинвазивного хирургического лечения кишечные, желчные, панкреатические свищи не требуют выполнения открытых хирургических вмешательств, а доступны консервативному лечению.
Таким образом, осуществляется перевод открытых вмешательств на брюшной полости и органах забрюшинного пространства при данной патологии из ранга основных во второстепенные.
Принцип опережения
Малоинвазивное хирургическое вмешательство с установкой дренажных систем в область преимущественного поражения поджелудочной железы осуществляется в максимально ранние сроки госпитализации, а не в фазу гнойных осложнений, как принято в большинстве лечебных учреждений.
Принцип обязательной панкреатической протоковой декомпрессии
Эндоскопические методы восстановления пассажа панкреатического сока в 12-перстную кишку (рассечение большого дуоденального сосочка, рассечение главного панкреатического протока, удаление камней из желчного протока) являются ключевыми факторами успешного лечения, поскольку без устранения протоковой гипертензии нет возможности прервать патологический процесс в поджелудочной железе или заживить панкреатические свищи.
Принцип индивидуальной курации
При панкреонекрозе нет одного (однократного) окончательного хирургического вмешательства, позволяющего излечить пациента. Хирургическая технология включает множественные этапные малоинвазивные вмешательства на выводных протоках поджелудочной железы, печени, на свободной брюшной полости, на забрюшинных некротических тканях и очагах гнойного поражения.
Принцип параллельности
Лечебные мероприятия проводятся в полном объеме с первых часов поступления пациента в стационар, не дожидаясь результатов от воздействия одного, отдельно взятого, из примененных методов (хирургической детоксикации, эфферентной детоксикации и т.д.).
Принцип каскадности
Малоинвазивные хирургические манипуляции выполняются непрерывно, окончание одной процедуры является стартом последующей.
Развитие постнекротических осложнений рассматривается как единый, неразрывный, идущий одновременно с изменениями в поджелудочной железе и окружающих тканях патологический процесс, а определяющей лечебную тактику особенностью течения острого деструктивного панкреатита является множественное протеолитическое поражение органов и токсическое поражение систем организма. Поэтому, основную часть времени пациент проводит в отделении интенсивной терапии, а в крайне тяжелых случаях – в реанимационном отделении, где с первых суток пребывания пациента применяют комплекс хирургических и терапевтических мероприятий:
Посиндромная коррекция сердечно-сосудистых, дыхательных нарушений (дыхательная аппаратура нового поколения — Пуритан, Пульмонетик и т.д.), лечение шока и полиорганной недостаточности.
Современные методики экстакорпоральной детоксикации (эфферентные методики – плазмоферез, плазмофильтрация, гемодиафильтрация, гемосорбция, ультрафильтрация).
Антибиотикотерапия выбора — последние поколения антибиотиков широкого спектра действия (карбопенемы, фторхинолоны (пефлоксацин) + антианаэробные препараты; цефалоспорины III–IV поколений + антианаэробные препараты), вплоть до получения результатов чувствительности микрофлоры.
Раннее полное парентеральное (внутривенное) питание до восстановления полноценного зондового питания и раннее энтеральное питание.
Отличительной особенностью нового подхода к интенсивной терапии является применение антибиотиков последних поколений с первых суток госпитализации и раннее питание пациентов. Замена дыхательной и следящей аппаратуры на самые современные устройства и применение всего спектра эфферентных методов детоксикации позволяют осуществлять функциональную поддержку на этапе полиорганной недостаточности.
При обращении пациента в первые часы заболевания, когда не представляется возможным однозначно оценить по какому «сценарию» в забрюшинном пространстве потечет заболевание у конкретного пациента и будет процесс ограниченным или распространенным, первичное хирургическое малоинвазивное вмешательство под ультразвуковым контролем (превентивное «мелкокалиберное» парапанкреатическое «дренирование») выполняется с целью хирургической детоксикации и профилактики гнойно-септических осложнений. При этом возможно введение лекарственных веществ через дренажные трубки, осуществление объективного контроля зоны патологических изменений по наличию и изменению характеристик экссудата. Посредством превентивных «мелкокалиберных» дренажей осуществляется первичный отток воспалительного экссудата.
В случае, когда заболевание у пациента при поступлении в центр уже достигло фазы гнойно-септических осложнений, то малоинвазивное оперативное вмешательство рассматривается как основной хирургический метод санации гнойно-некротических очагов.
Интраскопические хирургические технологии
При ультразвуковом исследовании выявляют скопления ферментативного выпота в брюшной полости, сальниковой сумке, забрюшинном пространстве и характерные для каждой формы поражения зоны пропитывания забрюшинной клетчатки.
В указанные области устанавливают дренажи диаметром 3 мм по принципу «не менее двух в один объект дренирования».
После фистулографии, на которой производится оценка характера распространения процесса в фазе некроза, под рентгенологическим контролем выполняют замену дренажей на двухпросветные большего диаметра. Данную процедуру необходимо повторять ежедневно, через день-два, в зависимости от конкретной клинической ситуации и состояния пациента. В конечном итоге, в зависимости от размера дренируемых полостей, дренажи могут достигать диаметра 5 – 20 мм.
В дальнейшем, при помощи видеоэндоскопа, выполняется чресфистульная санация забрюшинных некротических полостей, секвестральных «полей», с коррекцией и заменой дренажей. При этом удаляются некротизированные ткани и сформировавшиеся секвестры.
Чем больше количество «мелкокалиберных» (тонких – 1,5 – 3,3 мм диаметром) дренажей первично устанавливается в каждую область распространения экссудата и некроза, тем легче в дальнейшем выполнять санирующие процедуры, т.к. не всегда расположение трубки позволяет изменить ее направление или заменить «крупнокалиберной» (более широкой – 5 – 20 мм). К тому же, в случае возникновения свища полого органа от пролежня, один из дренажей можно удалить без ущерба для дренирования данной полости.
Применение видеофиброэндоскопа позволяет визуализировать пораженное забрюшинное пространство, поджелудочную железу и объективно оценить адекватность удаления некротизированных тканей с возможным проведением следующего двухпросветного «крупнокалиберного» дренажа в труднодоступный «карман», даже под острым углом к траектории первого «мелкокалиберного» дренажа.
По мере очищения полостей и уменьшения их размера, происходит обратный процесс замены дренажей на меньший диаметр и постепенное их удаление до закрытия свищевых ходов.
Одновременно с внедрением новых технологических приемов, требуется перестройка врачебного и сестринского ухода, изменение некоторых ключевых принципов формирования медицинского персонала и инструментального обеспечения:
Принцип высококвалифицированной врачебной универсальности.
Новые технологии лечения требуют проведения врачом практически ежедневных малоинвазивных хирургических вмешательств (основных хирургических вмешательств) по санации очагов некроза и нагноения под сочетанным сонографическим, эндоскопическим и рентгенологическим контролем в условиях рентгеноперационной под общей анестезией. Таким образом, врач, осуществляющий лечение деструктивного панкреатита по современным методикам, должен в совершенстве владеть несколькими специальностями – хирургия, интенсивная терапия, ультразвуковая диагностика, рентгенодиагностика, эндоскопия.
Иной подход – несколько специалистов, каждый из которых владеет только своей специальностью, не позволяет проводить лечение на требуемом современном уровне, сохранять преемственность этапов лечения и целостность понимания проблем пациента со скрытой от достоверной визуализации патологией забрюшинного пространства. Использование для решения поставленных задач одного универсального специалиста отвечает требованиям интенсивного технологического подхода к комплексному минимально инвазивному хирургическому лечению панкреонекроза.
Принцип манипуляционной иерархии.
Малоинвазивная технология лечения деструктивного панкреатита требует проведения ежечасных санационных хирургических манипуляций в палате интенсивной терапии (вспомогательных хирургических вмешательств). Данная хирургическая манипуляция основана на санации дренажных систем, установленных у пациента в очагах некроза и гнойного процесса. В промежутках времени между врачебными хирургическими вмешательствами проводится промывание, санация зон поражения, коррекция дренажных систем медицинским персоналом палаты.
Для этих целей требуется высокоспециализированный помощник врача. В его роли может выступать: медицинская сестра со специальным хирургическим образованием (в настоящее время формируется система получения средним медперсоналом высшего медицинского сестринского образования на базе медицинских ВУЗов); помощник врача (хирургическая сестра с высшим образованием; студент медицинского ВУЗа 3-6 курсов); младший врач (интерн, клинический ординатор, аспирант, врач на стажировке, врач со стажем до 3 лет). Особенностью хирургического ухода является контроль и проведение активных фракционных и постоянных дренажно-промывных и корригирующих процедур в течение 24 часов с минимальным перерывом 30-60 мин.
Принцип инструментальной аккумуляции.
Поскольку методики малоинвазивного лечения панкреонекроза требуют комбинации нескольких способов интраскопии, оснащение операционной и всего лечебного процесса должно отвечать современным стандартам. Основное инструментальное оборудование операционной для манипуляций под интраскопическим контролем включает хирургический ультразвуковой сканер, рентгентелевизионную установку и эндоскопическую стойку с системой жестких и гибких эндоскопов.
В комплекс средств визуализации требуемых технологией лечения панкреонекроза в обязательном порядке входят компьютерная или магнитнорезонансная томографии, как незаменимый этап диагностики некоторых зон некротического и гнойного поражения, не доступных сонографическим методикам.
Необходимым условием осуществления вышеуказанных принципов является изменение психологии врача для приобретения навыков малоинвазивных хирургических вмешательств на поджелудочной железе и забрюшинной клетчатке при панкреонекрозе под комбинированным интраскопическим контролем.
Объективным результатом работы новой функциональной единицы в ФГУ «РЦФХГ Росздрава» явилось неуклонное снижение летальности. В период превалирования открытых методов хирургического лечения панкреонекроза, при несущественной доле малоинвазивных технологий, летальность в этой группе пациентов была более 50%. При этом треть пациентов погибала в первые 10 суток после госпитализации от прогрессирующего циркуляторно-токсического шока, 28% больных погибали в сроки более 60 суток от аррозивного кровотечения. Остальными причинами летальности в основном были сепсис и синдром полиорганной недостаточности.
На этапе постепенного отказа от открытых операций летальность получила достаточно устойчивую тенденцию к снижению и, несмотря на «запущенность» поступающих в панкреатологический центр пациентов, колеблется от 4% до 8% в период 2003 — 2005 г.г.
Открытые оперативные вмешательства на брюшной полости и органах забрюшинного пространства остались на вооружении хирургов Центра только как средство борьбы с массивным аррозивным кровотечением, неподдающемся консервативным и ангиорентгенхирургическим методам гемостаза, или для выполнения коло- и илеостомии при острой кишечной непроходимости.
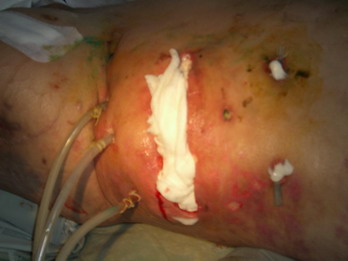
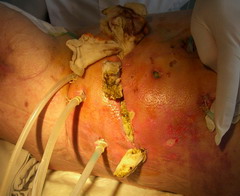
Лечение панкреонекроза
традиционным способом
Лечение панкреонекроза
малоинвазивными технологиями
Резюме
Преимущества комплексной малоинвазивной хирургической технологии лечения острого деструктивного панкреатита:
- Предотвращение развития панкреонекроза и гнойных осложнений при деструктивном панкреатите (абортивное течение острого панкреатита).
- Снижение летальности, причинами которой являются кровотечения, гнойно-септические осложнения, общая операционная травма.
- Уменьшение количества осложнений, связанных с интраоперационным кровотечением.
- Уменьшение количества вторичной внутрисекреторной недостаточности.
- Уменьшение инвалидизации пациентов.
- Хороший косметический эффект (отсутствуют лапаротомные и люмботомные рубцы, в том числе от ран, заживших вторичным натяжением, отсутствует необходимость в последующей пластике кожных ран и грыж).
Автор к.м.н. Новиков С.В.
Для получения более полной информации или очной консультации, с автором можно связаться по тел. +79851952791 или по электроной почте (medbaza23@mail.ru)
Источник