Билиарнозависимый панкреатит клинические рекомендации
В статье рассматриваются основные причины возникновения острого и хронического билиарнозависимого панкреатита и особенности его лечения. Проанализирован клинический случай острого билиарного панкреатита, развившегося на фоне лечения желчнокаменной болезни, с дальнейшим формированием хронического панкреатита в результате персистирования билиарного сладжа.
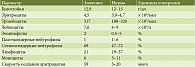
Таблица 1. Клинический анализ крови
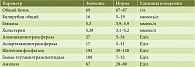
Таблица 2. Биохимический анализ крови
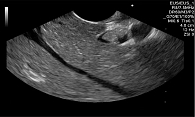
Замазкообразная желчь в терминальном отделе общего желчного протока
Как показали результаты ретроспективного (20-летний период) исследования, посвященного анализу причин развития острого панкреатита, билиарнозависимый панкреатит встречается у 26,9% пациентов [1]. Основной причиной его развития является желчнокаменная болезнь (ЖКБ). Острый панкреатит рассматривается как одно из основных осложнений ЖКБ [2].
Последние десятилетия во всем мире наблюдается тенденция к увеличению частоты развития билиарного панкреатита в результате роста заболеваемости ЖКБ [3]. Так, по данным разных авторов, частота развития билиарного панкреатита у больных ЖКБ составляет 25–90% [4].
Ведущим фактором в патогенезе билиарного панкреатита является повышение давления в желчных протоках вследствие возникновения механического препятствия (конкремент, билиарный сладж, стриктура, опухоль и др.), особенно дистальнее места слияния общего желчного с главным панкреатическим протоком, либо дисфункции сфинктера Одди. Развитие на этом фоне патологического билиопанкреатического рефлюкса и нарушение оттока панкреатического секрета могут привести к возникновению острого билиарного панкреатита [5].
Билиарнозависимый панкреатит отличается от панкреатита иной этиологии (алкогольный, алиментарный, посттравматический) тем, что этиологический фактор, как правило, не устраняется. Его воздействие продолжается на фоне развивающегося процесса в поджелудочной железе (ПЖ) и парапанкреатической клетчатке [6].
Особое значение в развитии билиарного панкреатита придается билиарному сладжу. Частота его выявления у больных с идиопатическим панкреатитом составляет 30–75%. При исследовании желчи в течение первых суток от начала панкреатической атаки билиарный сладж выявляется в 80% случаев [7].
В одном из исследований ученые наблюдали за 104 пациентами с билиарным сладжем в течение 630 дней (21 месяц). У 25 (24%) больных развились осложнения, такие как холелитиаз, холецистит, холедохолитиаз и панкреатит. При этом у 12 пациентов отмечался некалькулезный холецистит, у двоих – острый калькулезный холецистит. Зарегистрировано шесть случаев холецистолитиаза, один случай холедохолитиаза, четыре – панкреатита [8].
Таким образом, клиническое значение билиарного сладжа переоценить сложно, поскольку он:
- служит источником камнеобразования: желчные камни образуются у 5–20% пациентов за 1–3-летний период;
- способствует развитию стриктур терминального отдела общего желчного протока и/или стенозирующего папиллита;
- может приводить к развитию острого холецистита, холангита, отключению желчного пузыря (при наличии замазкообразной желчи);
- является причиной билиарного панкреатита.
Кроме того, билиарный сладж, содержащий микролиты, может свободно проходить по протоковой системе и вызывать необъяснимые боли в правом подреберье у 83% больных [9].
Билиарный сладж формируется в желчном пузыре в результате дестабилизации физико-химического состояния желчи и преципитации ее основных компонентов.
К факторам, способствующим персистенции билиарного сладжа, относятся гипотония желчного пузыря и гипертонус сфинктера Одди. Постоянный пассаж сладжа по желчным путям приводит к повреждению слизистой оболочки, главным образом в области сфинктера Одди. Травматизация слизистой оболочки вызвана микролитами, составляющими основную часть билиарного сладжа. Как следствие, сначала развивается вторичная дисфункция сфинктера Одди, затем формируется стенозирующий папиллит [4].
Помимо конкрементов и билиарного сладжа обострения панкреатита могут быть вызваны дисфункцией сфинктера Одди [10], в том числе у больных после холецистэктомии [11]. Так, у 18,8% пациентов с хотя бы одним эпизодом острого панкреатита или хроническим идиопатическим панкреатитом выявляется панкреатический тип дисфункции сфинктера Одди [11].
Фармакотерапия билиарнозависимого панкреатита может быть этиологической и патогенетической. При наличии показаний (ЖКБ, обструкция желчного потока) проводится эндоскопическое или хирургическое лечение.
Этиологическая терапия предполагает использование препаратов урсодезоксихолевой кислоты (УДХК). Патогенетическая зависит от типа преобладающих нарушений. При гипомоторных нарушениях назначают прокинетики (домперидон, итоприд), при гипермоторных – спазмолитики (мебеверин). Применяют также комбинированные препараты, оказывающие одновременно и холеретическое, и спазмолитическое действие.
По механизму действия спазмолитики подразделяют на нейротропные и миотропные. Нейротропные блокируют процесс передачи нервных импульсов в вегетативных ганглиях и нервных окончаниях, стимулирующих гладкомышечные клетки. Они осуществляют блокаду М1-, М2- и М3-холинорецепторов гладкой мышечной клетки. Среди нейротропных спазмолитиков выделяют:
- природные: атропин, гиосциамин, препараты красавки, платифиллин, скополамин;
- синтетические центральные: адифенин, апрофен, апринал, циклозил;
- полусинтетические периферические: гиосцина бутилбромид.
Миотропные спазмолитики уменьшают мышечный тонус за счет прямого воздействия на гладкомышечные клетки. К таким спазмолитикам относятся блокаторы ионных каналов, ингибиторы фосфодиэстеразы (ФДЭ) 4-го типа, нитраты. Миотропные спазмолитики подразделяют:
- на селективные:
- блокаторы кальциевых каналов (пинаверия бромид, отилония бромид);
- блокаторы натриевых каналов (мебеверин) и донаторы оксида азота (изосорбида динитрат, нитроглицерин, натрия нитропруссид);
- неселективные: ингибиторы ФДЭ (дротаверин, папаверин, аминофиллин, бенциклан) [12].
Что касается патогенетической терапии, препаратом выбора для пациентов с функциональными заболеваниями билиарного тракта являются лекарственные средства, селективно релаксирующие гладкую мускулатуру органов желудочно-кишечного тракта. Препараты этой группы, в частности мебеверин, обладают релаксирующей селективностью в отношении сфинктера Одди, в 20–40 раз превышающей эффект папаверина. При этом мебеверин оказывает нормализующее действие на мускулатуру кишечника, устраняя функциональный дуоденостаз, гиперперистальтику, спазм и не вызывая при этом нежелательной гипотонии [13].
Рассмотрим клинический пример, демонстрирующий результат успешного лечения билиарнозависимого панкреатита за счет назначения этиологической и патогенетической терапии.
Больная К. 76 лет была госпитализирована в отделение патологии поджелудочной железы и желчевыводящих путей Московского клинического научно-практического центра им. А.С. Логинова для обследования и лечения по поводу неоднократного обострения хронического панкреатита.
При поступлении – жалобы на боли в верхней половине живота с иррадиацией в спину и грудную клетку, усиливающиеся после еды, тошноту, отрыжку, снижение массы тела на 16 кг за два года.
Из анамнеза известно, что боли в животе впервые появились несколько лет назад. Больная была госпитализирована с болевым синдромом. Диагностированы холедохолитиаз, механическая желтуха. Проведены эндоскопическая папиллосфинктеротомия, экстракция конкремента холедоха, осложнившаяся панкреонекрозом. Проведено консервативное лечение. Через полгода отмечалось повторное ухудшение – интенсивный болевой синдром. Пациентка была вновь госпитализирована. Диагноз: хронический панкреатит, обострение. Через два года выполнена лапароскопическая холецистэктомия. В течение года боли не беспокоили, однако через год они возобновились. Последующие полгода пациентка с диагнозом «обострение хронического панкреатита, транзиторный холедохолитиаз» находилась на стационарном лечении.
При объективном осмотре состояние удовлетворительное, кожные покровы и видимые слизистые оболочки чистые, обычной окраски. Тургор снижен. Отеков нет. В легких дыхание везикулярное, хрипов нет. Тоны сердца приглушены, ритм правильный. Частота сердечных сокращений – 76 уд/мин. Артериальное давление – 120/80 мм рт. ст. Язык влажный, обложен белым налетом. Живот обычной конфигурации, в эпигастральной области и правом подреберье звездчатые рубцы. При пальпации живот мягкий, болезненный в эпигастральной области. Печень у края реберной дуги, селезенка не пальпируется.
Лабораторно-инструментальные исследования. Клинический анализ крови без патологических отклонений (табл. 1). В биохимическом анализе крови умеренный холестаз (табл. 2). Фекальная эластаза – свыше 200 мкг/г. Эзофагогастродуоденоскопия. Парапапиллярный дивертикул. Состояние после папиллотомии.
Ультразвуковое исследование органов брюшной полости. Признаки диффузного заболевания печени. Билиарная гипертензия. Расширение гепатикохоледоха. Не исключен холедохолитиаз, хотя конкремент не визуализируется. Диффузные изменения поджелудочной железы (признаки хронического панкреатита).
Для определения дальнейшей тактики лечения выполнена эндосонография панкреатобилиарной зоны. Визуализирована замазкообразная желчь в общем желчном протоке (рисунок).
Вероятно, именно замазкообразная желчь в терминальном отделе общего желчного протока стала причиной частых обострений хронического билиарнозависимого панкреатита.
Для уменьшения литогенности желчи больной назначили препарат УДХК Эксхол® 500 мг в делимых таблетках в дозе 750 мг/сут в три приема. Благодаря такой форме выпуска Эксхол® 500 мг можно гибко дозировать, сокращая количество принимаемых таблеток [14]. При выборе препаратов УДХК это очень важно. Не менее значимый фактор – экономическая составляющая. Выбор препарата в рассматриваемом случае был обусловлен доступностью длительного курсового лечения.
С целью купирования болевого синдрома, устранения спазма и улучшения пассажа желчи в кишку был назначен Спарекс® по 200 мг в два приема перед едой. Через три месяца лечения отмечалась положительная динамика в виде полного купирования болевого синдрома, нормализации биохимических показателей. Наблюдение за больной в последующие шесть месяцев показало отсутствие рецидивов билиарнозависимого панкреатита.
По данным Н.А. Агафоновой и соавт. [14], российский препарат мебеверина Спарекс® не только купирует боль, но и улучшает реологические свойства желчи при ЖКБ.
Оценка безопасности и переносимости мебеверина проводилась в исследованиях, включивших свыше 3500 больных [13]. Во всех исследованиях отмечалась хорошая переносимость препарата без развития побочных эффектов, в том числе при увеличении дозы. Мебеверин не вызывает гематологических и биохимических изменений, не оказывает типичных антихолинергических эффектов, в связи с чем может назначаться пациентам с гипертрофией предстательной железы и глаукомой [13], что актуально для пожилых больных.
Таким образом, несмотря на проведенную папиллосфинктеротомию, отток желчи был нарушен, что в свою очередь провоцировало обострения хронического панкреатита. Данных о формировании стриктур не получено. В связи с этим хирургическое вмешательство было нецелесообразным. Ситуация была разрешена путем применения препарата УДХК (Эксхол®) и селективного миотропного спазмолитика (Спарекс®).
Источник
Аннотация
В статье отражены основные положения последних российских и панъевропейских клинических рекомендаций по диагностике и лечению хронического панкреатита (ХП), посвященные фармакотерапии данного заболевания. Главными задачами фармакотерапии ХП можно назвать уменьшение или купирование болевого абдоминального синдрома и предотвращение или компенсацию функциональной панкреатической недостаточности.
Ключевые слова: хронический панкреатит, внешнесекреторная недостаточность поджелудочной железы, купирование боли, заместительная ферментная терапия.
Pharmacotherapy of chronic pancreatitis in terms of current clinical recommendations
I.V. Maev1, Т.В. Bideeva1, Yu.A. Kucheryavyy1, D.N. Andreev1, A.O. Bueverov2
1A.I. Evdokimov Moscow State University of Medicine and Dentistry, Ministry of Health of Russia, Moscow, Russia
2I.M. Sechenov First Moscow State Medical University, Ministry of Health of Russia (Sechenov University), Moscow, Russia
The article reflects the main positions of the latest Russian and pan-European clinical recommendations on the diagnosis and treatment of chronic pancreatitis (CP), devoted to the pharmacotherapy of this disease. The main objectives of pharmacotherapy for CP are to reduce or arrest pain abdominal syndrome and prevent or compensate for functional pancreatic insufficiency.
Keywords: chronic pancreatitis, exocrine pancreatic insufficiency, pain relief, substitution enzyme therapy
Хронический панкреатит (ХП) – это прогрессирующее воспалительное заболевание, приводящее к структурным и фиброзным изменениям поджелудочной железы (ПЖ), нарушению ее эндокринной и экзокринной функций [1].
Объективная эпидемиологическая структура ХП неопределенна вследствие сложности ранней диагностики и особенностей клинического течения данного заболевания. Однако в современной литературе указывается на рост заболеваемости и распространенности ХП [2, 3]. Так, в ходе исследования, проведенного клиникой Мейо, было выявлено увеличение заболеваемости с 2,94 на 100 тыс. населения в 1977–1986 гг. до 4,35 на 100 тыс. в 1997–2006 гг. [2]. Ретроспективное исследование, проведенное в период с 1996 по 2003 г. в Китае, показало, что распространенность ХП возросла с 3,08 до 13,52 на 100 тыс. населения [3]. В России распространенность ХП у взрослых составляет 27,4–50,0 случая на 100 тыс. населения [4]. В Московском регионе за последнее десятилетие она увеличилась в 3 раза, а у подростков этот показатель вырос в 4 раза [4]. Считается, что данная тенденция связана с увеличением потребления алкоголя, зачастую низкого качества, снижением качества питания и уровня жизни. Обычно ХП развивается у пациентов среднего возраста; в развитых странах отмечено снижение возраста момента установления диагноза с 50 до 39 лет, среди заболевших на 30% увеличилась доля женщин [4].
Смертность при ХП составляет почти 50% в течение 20–25 лет после постановки диагноза [4, 5] из-за инфекционных осложнений, нутритивной недостаточности, осложнений рецидивов панкреатита. Кроме того, считается, что именно ХП детерминирует развитие рака ПЖ и увеличивает риск его появления как минимум в 13,3 раза [6]. У пациентов с ХП и диабетом риск развития рака ПЖ повышен в 33 раза [7].
К основным осложнениям ХП относят экзокринную и эндокринную недостаточность. Экзокринная недостаточность может протекать с прогрессированием заболевания, клинически проявляется потерей массы тела, мальабсорбцией, стеатореей. Эндокринная недостаточность развивается вторично и связана с разрушением клеток островков Лангерганса; в конечном счете она может привести к сахарному диабету. Еще одним осложнением ХП являются псевдокисты, 39% которых у больных могут спонтанно резорбироваться [8]. Достаточно крупные псевдокисты могут быть причиной интенсивной боли, компрессии сосудов, кровотечения, экстракорпорального стеноза двенадцатиперстной кишки или холедоха [9].
Проблеме лечения пациентов с ХП было посвящено большое количество клинических исследований различного дизайна, проведенных за последние несколько лет. Основные результаты этих работ были проанализированы и систематизированы профильными медицинскими ассоциациями, занимающимися проблемой ХП. Эти данные легли в основу разработки и обновления практических рекомендаций по ведению пациентов с ХП. В настоящей статье отражены основные положения, касающиеся фармакотерапии ХП, с позиций последних российских и панъевропейских клинических рекомендаций [10–13].
Фармакотерапия
Целями лечения ХП являются: купирование боли; коррекция эндокринной и экзокринной панкреатической недостаточности; коррекция трофологического статуса; улучшение качества жизни; предупреждение развития осложнений заболевания. При этом главными задачами фармакотерапии ХП можно назвать уменьшение или купирование абдоминальной боли и предотвращение или компенсацию функциональной панкреатической недостаточности [1].
Купирование боли. Боли в животе являются наиболее частым и стойким симптомом у пациентов с ХП, поэтому большинство методов лечения сосредоточены на облегчении абдоминальной боли. Результаты последних исследований показывают, что возникновению рецидивирующей боли способствуют прогрессирующее развитие фиброза и потеря функционирующей ткани ПЖ, а также нарушение протоковой секреции наряду с хроническим воспалением с вовлечением внутрипанкреатических нервных окончаний и развитием боли нейропатического типа [14, 15].
Традиционное обезболивание начинается с изменения образа жизни. В большинстве случаев прекращение злоупотребления алкоголем и курения может как предотвратить прогрессирование заболевания, так и обеспечить облегчение боли [9, 15].
Согласно рекомендациям, при интенсивной боли показано периодическое или курсовое назначение ненаркотических анальгетиков (парацетамола или нестероидных противовоспалительных средств – НПВС), при неэффективности следует отдавать предпочтение трамадолу. Препараты следует принимать за 30 мин до еды для минимизации усиления боли после приема пищи. Трициклические антидепрессанты, такие как амитриптилин, также могут быть использованы для уменьшения невропатической боли [16]. В последнее время для уменьшения боли часто применяется прегабалин [17, 18].
Известно, что у пациентов с ХП снижение секреции панкреатических ферментов при внешнесекреторной недостаточности может приводить к гиперстимуляции ПЖ высокими дозами холецистокинина в плазме крови и, следовательно, к абдоминальной боли. Таким образом, применение полиферментных препаратов с высокой протеолитической способностью может быть оправданным для уменьшения панкреатической боли. При этом использование некапсулированных энзимов считается малоэффективным [4] и регистрируемый эффект от их применения может быть отнесен к плацебо-эффекту. Хотя метаанализ, проведенный в 1997 г., не выявил значительного преимущества заместительной ферментной терапии (ЗФТ) в отношении облегчения боли [19], тем не менее ЗФТ показана пациентам с внешнесекреторной недостаточностью поджелудочной железы (ВНПЖ) и стеатореей [20].
Еще один метод ингибирования секреции ПЖ – применение соматостатина и его синтетического пролонгированного аналога октреотида. Несмотря на оптимистичные результаты применения октреотида у больных болевыми формами ХП, в настоящее время его не рекомендуют для лечения хронической боли вследствие существенного увеличения числа побочных эффектов при длительном его применении, а также возможного усугубления мальдигестии за счет резкого снижения выделения панкреатических ферментов, развития пареза кишечника и увеличения вероятности камнеобразования в желчном пузыре [4].
Антиоксидантная терапия представляется еще одним потенциальным методом лечения боли у пациентов с ХП. J.M. Braganza [21] предположил, что одним из механизмов развития ХП и персистирования абдоминальной боли является оксидативный стресс, что приводит к повреждению ацинарных клеток ПЖ. Современные данные свидетельствуют о том, что снижение уровня антиоксидантов у пациентов с ХП может быть связано с дефицитом питания, ситофобией и мальабсорбцией соответственно. Недавний метаанализ показал снижение абдоминальной боли на фоне приема антиоксидантов, состоящих из органического селена, аскорбиновой кислоты, бета-каротина, альфа-токоферола и метионина [22]. Сочетание этих антиоксидантов описывается в трех контролируемых клинических испытаниях [23–25]. В первом клиническом исследовании эффективность антиоксидантной терапии в лечении панкреатита определяли с помощью вышеуказанной комбинации у больных ХП (n=28). Применяли следующую схему: 600 мг органического селена, 0,54 г аскорбиновой кислоты,
9000 МЕ бета-каротина, 270 МЕ альфа-токоферола, 2 г метионина ежедневно в течение 6 мес. Результаты показали, что эта терапия может уменьшить панкреатическую боль у пациентов [25]. Еще в одном исследовании с небольшим размером выборки (n=36) описано использование вышеописанной комбинации в тех же дозах, но с большей биодоступностью у больных ХП. Результаты этого исследования совпадают с предыдущим исследованием: боль купировалась после 10 нед комбинированного антиоксидантного лечения. Качество жизни, физическое и социальное состояние, восприятие здоровья также улучшились в результате антиоксидантной терапии [23]. Последние опубликованные контролируемые клинические исследования в области антиоксидантов и панкреатита также представляют эту комбинацию в тех же дозах, что и предыдущие исследования. В крупных клинических исследованиях
(n=147) антиоксиданты назначались на 6 мес, и в них, как и в двух предшествующих исследованиях, показано снижение интенсивности боли и длительности госпитализации [24]. Все три исследования продемонстрировали, что сывороточные концентрации вышеупомянутых антиоксидантов были выше после лечения, а лабораторные показатели содержания маркеров окислительного стресса, таких как перекисное окисление липидов, активность свободных радикалов и антиоксиданты, улучшились после терапии.
Как ранее было отмечено, абдоминальная боль может быть обусловлена секреторным напряжением в ПЖ, увеличением в ней объема панкреатического сока и высокой концентрации ферментов. В связи с этим представляется логичным, что снижение экзокринной секреции ПЖ может привести к уменьшению протокового и тканевого давления и редукции болевого синдрома. Этого можно достичь опосредованно через ингибирование синтеза соляной кислоты, что может снизить образование секретина и холецистокинина, а также своевременную активацию полиферментных препаратов непосредственно в двенадцатиперстной кишке за счет стойкого повышения гастродуоденального рН. Наиболее эффективными ингибиторами секреции в настоящее время считаются ингибиторы протонной помпы (ИПП), длительное действие которых способствует быстрой и адекватной редукции боли [1], однако ни один из существующих препаратов этой группы не апробирован в плацебо-контролируемых исследованиях, что отражается на отсутствии официальных показаний применения ИПП при ХП.
Компенсация внешнесекреторной недостаточности поджелудочной железы. Согласно панъевропейским рекомендациям по диагностике и лечению ХП, ЗФТ показана пациентам с ХП и ВНПЖ при наличии клинических симптомов или лабораторных признаков мальабсорбции [13]. Ферментные препараты при экскреторной недостаточности, как правило, назначаются пожизненно, однако их доза может варьировать в зависимости от тяжести состояния, выраженности экзокринной недостаточности, соблюдения больным диеты и многих других факторов [1, 26].
Микротаблетки и минимикросферы, покрытые кишечнорастворимой оболочкой, эффективнее таблетированных препаратов при лечении стеатореи, поскольку предотвращается инактивация липазы под действием кислоты в желудке и имеется улучшенная фармакокинетика, обеспечивающая более вероятный контакт ферментов с химусом и большую площадь контакта [27]. Важно отметить, что активность ферментных препаратов определяется содержанием в них липазы [10, 11]. Это обусловлено тем, что при патологии ПЖ секреция липазы нарушается раньше, чем амилазы и протеолитических ферментов. Липаза по сравнению с амилазой и протеазами в большей степени подвергается протеолитическому гидролизу. Таким образом, дозы препаратов панкреатина подбираются по количеству липазы (см. таблицу).
Согласно российским рекомендациям, пациент должен получать не менее 25–40 тыс. ЕД липазы на основной прием пищи и 10–25 тыс. единиц на промежуточный прием [10]. В положениях панъевропейского консенсуса по ХП рекомендованная минимальная доза липазы для начальной терапии составляет 40–50 тыс. ЕД с основными приемами пищи и половина этой дозы – в промежуточный прием пищи [13]. Эффективность ЗФТ зависит от адекватности перемешивания микрочастиц панкреатина с химусом, что определяет необходимость принимать препарат во время еды. Если за один прием пищи нужно принимать больше одной капсулы, разумно разделить прием всей дозы – дробно в течение всего приема пищи [13].
Об эффективности ЗФТ можно объективно судить по облегчению симптомов, связанных с мальдигестией (стеаторея, потеря массы тела, метеоризм), и нормализации нутритивного статуса пациентов [28, 29]. У пациентов, недостаточно ответивших на лечение, может оказаться полезным использование функциональных исследований ПЖ (анализ на коэффициент абсорбции жира или дыхательный тест с использованием 13C-смешанных триглицеридов) на фоне ЗФТ. Недавний обзор подтверждает, что оптимальным способом оценки эффективности ЗФТ является нормализация параметров нутритивного статуса – как антропометрических, так и биохимических [30].
Отсутствие полноценного эффекта ЗФТ может быть обусловлено вторичными механизмами. Успех ЗФТ нельзя оценить по концентрации фекальной эластазы-1, поскольку в этом случае измеряется только концентрация натурального человеческого фермента, а не терапевтически введенного фермента, содержащегося в панкреатине. Анализ на экскрецию химотрипсина с калом не дает информации о влиянии ЗФТ на пищеварение и абсорбцию питательных веществ, однако его можно использовать для проверки комплаентности (низкие значения соответствуют неправильному приему препаратов) [31]. Только дыхательный тест с использованием 13C-смешанных триглицеридов позволяет эффективно оценить усвоение жира и пригоден для мониторинга эффективности ЗФТ [32], однако этот метод пока недоступен в Российской Федерации ввиду незарегистрированного субстрата для тестирования.
В случае неудовлетворительного клинического ответа ЗФТ следует увеличить дозу ферментов (удвоить или утроить) или добавить к терапии ИПП (см. рисунок). Хотя убедительных научных данных, подтверждающих это, недостаточно, клинический опыт показывает, что некоторым пациентам требуется удвоение или утроение этой дозы, которое оказывается эффективным. Ингибирование секреции желудочного сока с помощью ИПП компенсирует недостаточный ответ на начальную дозу фермента [33]. Пока остается неясным, что более эффективно у этих пациентов – повышение дозы ферментов или добавление ИПП, поэтому обе стратегии следует рассматривать как приемлемые [13].
Адекватная заместительная терапия ферментами ПЖ значительно улучшает качество жизни у пациентов с недавно диагностированным и никогда не леченным ХП и у больных, получавших ЗФТ в недостаточных дозах; установлена достоверная взаимосвязь между улучшением показателей качества жизни и массой тела или уменьшением выделения жира с калом.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах:
Маев Игорь Вениаминович – д.м.н., проф., акад. РАН, зав. каф. пропедевтики внутренних болезней и гастроэнтерологии МГМСУ им. А.И. Евдокимова
Бидеева Татьяна Викторовна – аспирант каф. пропедевтики внутренних болезней и гастроэнтерологии МГМСУ им. А.И. Евдокимова
Кучерявый Юрий Александрович – к.м.н., доц. каф. пропедевтики внутренних болезней и гастроэнтерологии МГМСУ им. А.И. Евдокимова
Буеверов Алексей Олегович – д.м.н., проф. каф. медико-социальной экспертизы, неотложной и поликлинической терапии Института профессионального образования Первого МГМУ им. И.М. Сеченова
Источник


